溫抗體型自身免疫溶血性貧血
| A+醫學百科 >> 溫抗體型自身免疫溶血性貧血 |
溫抗體型自身免疫溶血性貧血是自身免疫性溶血性貧血(AIHA)的一個類型,除此之外,尚有冷抗體型自身免疫溶血性貧血。溫抗體型自身免疫溶血性貧血的抗體為IgG或C3,少數為IgM。37℃最活躍(這也是為什麼命名為溫抗體型的原因,冷抗體型為20°C),為不完全抗體,吸附於紅細胞的表面。致敏紅細胞易被巨噬細胞所破壞,部分膜被破壞可形成球形紅細胞。IgG和C3抗體同時存在可引起比較嚴重的溶血。
原因不明的原發性AIHA佔45%。繼發性的病因有:①感染,特別是病毒感染;②結締組織病,如系統性紅斑狼瘡、類風濕關節炎,潰瘍性結腸炎等;③淋巴增殖性疾病,如慢性淋巴細胞白血病、淋巴瘤、骨髓瘤等;④藥物,如青黴素,頭孢菌素,甲基多巴,氟達拉賓等。
目錄 |
臨床表現和診斷
急性型多發生於小兒伴病毒感染者,偶也見於成人。起病急驟,有寒戰、高熱、腰背痛、嘔吐。嚴重時,有休克、昏迷。多數溫抗體型AIHA起病緩慢,成人多見,無性別差異。表現為虛弱及頭昏。體征包括皮膚黏膜蒼白,黃疸;輕中度脾大(50%),質較硬,無壓痛;中度肝大(30%),肝質地硬但無壓痛。貧血程度不一,系正常細胞貧血,外周血片可見球形細胞。1/3的患者血片中可見數量不等的幼紅細胞。網織紅細胞增高,個別可高達0.50。急性溶血階段白細胞增多。約10%~20%的患者合併免疫性血小板減少,稱為Evans症候群;骨髓有核細胞增生,以幼紅細胞增生為主。
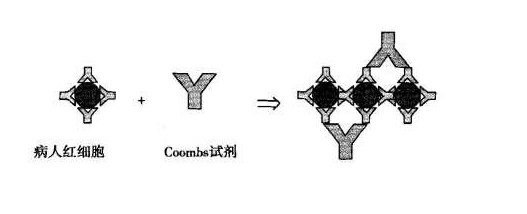
直接法抗人球蛋白試驗(Coombs試驗)是測定吸附在紅細胞膜上的不完全抗體和補體較敏感的方法,是診斷AIHA的重要依據。在生理鹽水內,吸附不完全抗體或補體的致敏紅細胞並無凝集,因為不完全抗體是單價的。加入完全、多價的抗人球蛋白抗體後,後者與不完全抗體Fc段相結合,起搭橋作用,可導致致敏紅細胞相互凝集,即直接Coombs試驗陽性。根據加入的抗人球蛋白不同,可鑒別使紅細胞致敏的是IgG抗體還是C3。間接抗人球蛋白試驗則可測定血清中游離的IgG或C3。
如有溶血性貧血,Coombs試驗陽性,近4個月內無輸血或可疑藥物服用史;冷凝集素效價正常,可以考慮溫抗體型AIHA的診斷。Coombs試驗陰性,但臨床表現較符合,糖皮質激素或切脾有效,除外其他HA(特別是遺傳性球形細胞增多症),可診斷為Coombs試驗陰性的AIHA。排除各種繼發性AIHA的可能,無病因查到者診斷為原發性AIHA。繼發性AIHA必須明確引起溶血的誘發疾病,可依據原發病的臨床表現和有關實驗室檢查加以鑒別。
治療
(一)腎上腺糖皮質激素
潑尼松1~1.5mg/(kg·d)分次口服。如治療3周無效,則更換其他療法。紅細胞數恢復正常後,維持治療劑量1個月。然後緩慢減量,小劑量潑尼松(5~10mg/d)持續至少6個月。82%的患者可獲早期全部或部分緩解,但僅有13%~16%的患者在撤除糖皮質激素後能獲長期緩解。作用機制:①抑制抗體產生,②減低抗體對紅細胞膜上抗原的親和力,③減少巨噬細胞上的IgG及C3受體,或抑制受體與紅細胞相結合。大劑量免疫球蛋白靜脈注射或血漿置換術也可取得一定療效,但作用不持久。
(二)脾切除
脾是產生抗體的器官,又是致敏紅細胞的主要破壞場所。溫抗體型AIHA切脾後,雖然紅細胞仍被致敏,但抗體對紅細胞壽命的影響卻減小了,術後有效率為60%。間接抗人球蛋白試驗陰性或抗體為IgG型者,切脾療效可能較好。術後複發病例再用糖皮質激素治療,仍可有效。
(三)免疫抑制劑
指征:①糖皮質激素和脾切除都不緩解者;②脾切除有禁忌者;③潑尼松量需10mg/d以上才能維持緩解者。常用達那唑,霉酚酸酯(MMF,驍悉),抗CD20的單抗(rituximab,美羅華),硫唑嘌呤,環磷醯胺等,可與激素同用。總療程約需半年左右。任何一種免疫抑制劑試用4周如療效不佳,應改用其他製劑。療程中須觀察藥物的不良反應。
(四)貧血較重者應輸洗滌紅細胞。
(五)繼發性AIHA積極尋找病因,治療原發病。
參看
參考文獻
《內科學》人民衛生出版社第七版醫學教材.陸再英、鍾南山主編
| 關於「溫抗體型自身免疫溶血性貧血」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |