臨床生物化學/層析法實驗技術
| 醫學電子書 >> 《臨床生物化學》 >> 常用分析技術在臨床生物化學中的應用 >> 層析技術的應用 >> 層析法實驗技術 |
| 臨床生物化學 |
|
|
|
(一)凝膠層析法
凝膠層析又稱分子篩過濾、排阻層析等。它的突出優點是層析所用的凝膠屬於惰性載體,不帶電荷,吸附力弱,操作條件比較溫和,可在相當廣的溫度範圍下進行,不需要有機溶劑,並且對分離成分理化性質的保持有獨到之處。對於高分子物質有很好的分離效果。
⒈凝膠的選擇根據實驗目的不同選擇不同型號的凝膠。如果實驗目的是將樣品中的大分子物質和小分子物質分開,由於它們在分配係數上有顯著差異,這種分離又稱組別分離,一般可選用Sephadex G-25和G-50,對於小肽和低分子量的物質(1000-5000)的脫鹽可使用Sephadex G-10,G-15及Bio-Gel-p-2或4。如果實驗目的是將樣品中一些分子量比較近似的物質進行分離,這種分離又叫分級分離。一般選用排阻限度略大於樣品中最高分子量物質的凝膠,層析過程中這些物質都能不同程度地深入到凝膠內部,由於Kd不同,最後得到分離。
⒉柱的直徑與長度根據經驗,組別分離時,大多採用2-30cm長的層析柱,分級分離時,一般需要100cm左右長的層析柱,其直徑在1-5cm範圍內,小於1cm產生管壁效應,大於5cm則稀釋現象嚴重。長度L與直徑D的比值L/D一般宜在7-10之間,但對移動慢的物質宜在30-40之間。
⒊凝膠柱的製備凝膠型號選定後,將干膠顆粒懸浮於5-10倍量的蒸餾水或洗脫液中充分溶脹,溶脹之後將極細的小顆粒傾瀉出去。自然溶脹費時較長,加熱可使溶脹加速,即在沸水浴中將濕凝膠漿逐漸升溫至近沸,1-2小時即可達到凝膠的充分脹溶。加熱法既可節省時間又可消毒。
凝膠的裝填:將層析柱與地面垂直固定在架子上,下端流出口用夾子夾緊,柱頂可安裝一個帶有攪拌裝置的較大容器,柱內充滿洗脫液,將凝膠調成較稀薄的漿頭液盛於柱頂的容器中,然後在微微地攪拌下使凝膠下沉於柱內,這樣凝膠粒水平上升,直到所需高度為止,拆除柱頂裝置,用相應的濾紙片輕輕蓋在凝膠床表面。稍放置一段時間,再開始流動平衡,流速應低於層析時所需的流速。在平衡過程中逐漸增加到層析的流速,千萬不能超過最終流速。平衡凝膠床過夜,使用前要檢查層析床是否均勻,有無「紋路」或氣泡,或加一些有色物質來觀察色帶的移動,如帶狹窄、均勻平整說明層析柱的性能良好,色帶出現歪曲、散亂、變寬時必須重新裝柱。
⒋加樣和洗脫凝膠床經過平衡後,在床頂部留下數亳升洗脫液使凝膠床飽和,再用滴管加入樣品。一般樣品體積不大於凝膠總床體積的5%-10%。樣品濃度與分配係數無關,故樣品濃度可以提高,但分子量較大的物質,溶液的粘度將隨濃度增加而增大,使分子運動受限,故樣品與洗脫液的相對粘度不得超過1.5-2。樣品加入後打開流出口,使樣品滲入凝膠床內,當樣品液面恰與凝膠床表面相平時,再加入數毫升洗脫液中洗管壁,使其全部進入凝膠床後,將層析床與洗脫液貯瓶及收集器相連,預先設計好流速,然後分部收集洗脫液,並對每一餾份做定性、定量測定。
⒌凝膠柱的重複使用、凝膠回收與保存一次裝柱後可以反覆使用,不必特殊處理,並不影響分離效果。為了防止凝膠染菌,可在一次層析後加入0.02%的疊氮鈉,在下次層析前應將抑菌劑除去,以免干擾洗脫液的測定。
如果不再使用可將其回收,一般方法是將凝膠用水沖洗乾淨濾干,依次用70%、90%、95%乙醇脫水平衡至乙醇濃度達90%以上,濾干,再用乙醚洗去乙醇、濾干、乾燥保存。濕態保存方法是凝膠漿中加入抑菌劑或水沖洗到中性,密封后高壓滅菌保存。
⒍凝膠層析的應用
⑴脫鹽:高分子(如蛋白質、核酸、多糖等)溶液中的低分子量雜質,可以用凝膠層析法除去,這一操作稱為脫鹽。本法脫鹽操作簡便、快速、蛋白質和酶類等在脫鹽過程中不易變性。適用的凝膠為SephadexG-10、15、25或Bio-Gel-p-2、4、6。柱長與直徑之比為5-15,樣品體積可達柱床體積的25%-30%,為了防止蛋白質脫鹽後溶解度降低會形成沉澱吸附於柱上,一般用醋酸銨等揮發性鹽類緩衝液使層析柱平衡,然後加入樣品,再用同樣緩衝液洗脫,收集的洗脫液用冷凍乾燥法除去揮發性鹽類。
⑵用於分離提純:凝膠層析法已廣泛用於酶、蛋白質、胺基酸、多糖、激素、生物鹼等物質的分離提純。凝膠對熱原有較強的吸附力,可用來去除無離子水中的致熱原製備注射用水。
⑶測定高分子物質的分子量:用一系列已知分子量的標準品放入同一凝膠柱內,在同一條件下層析,記錄每一分鐘成分的洗脫體積,並以洗脫體積對分子量的對數作圖,在一定分子量範圍內可得一直線,即分子量的標準曲線。測定未知物質的分子量時,可將此樣品加在測定了標準曲線的凝膠柱內洗腫後,根據物質的洗脫體積,在標準曲線上查出它的分子量。
⑷高分子溶液的濃縮:通常將SephadexG-25或50干膠投入到稀的高分子溶液中,這時水分和低分子量的物質就會進入凝膠粒子內部的孔隙中,而高分子物質則排阻在凝膠顆粒之外,再經離心或過濾,將溶脹的凝膠分離出去,就得到了濃縮的高分子溶液。
(二)離子交換層析法
離子交換層析法是以具有離子交換性能的物質作固定相,利用它與流動相中的離子能進行可逆的交換性質來分離離子型化合物的一種方法。
⒈離子交換劑預處理和裝柱對於離子交換纖維素要用流水洗去少量碎的不易沉澱的顆粒,以保證有較好的均勻度,對於已溶脹好的產品則不必經這一步驟。溶脹的交換劑使用前要用稀酸或稀鹼處理,使之成為帶H+或OH-的交換劑型。陰離子交換劑常用「鹼-酸-鹼」處理,使最終轉為-OH-型或鹽型交換劑;對於陽離子交換劑則用「酸-鹼-酸」處理,使最終轉為-H-型交換劑。洗滌好的纖維素使用前必須平衡至所需的pH和離子強度。已平衡的交換劑在裝柱前還要減壓除氣泡。為了避免顆粒大小不等的交換劑在自然沉降時分層,要適當加壓裝柱,同時使柱床壓緊,減少死體積,有利於解析度的提高。柱子裝好後再用起始緩衝液淋洗,直至達到充分平衡方可使用。
⒉加樣與洗脫加樣:層析所用的樣品應與起始緩衝液有相同的pH和離子強度,所選定的pH值應落在交換劑與被結合物有相反電荷的範圍,同時要注意離子強度應低,可用透析、凝膠過濾或稀釋法達此目的。樣品中的不溶物應在透析後或凝膠過濾前,以離心法除去。為了達到滿意的分離效果,上樣量要適當,不要超過柱的負荷能力。柱的負荷能力可用交換容量來推算,通常上樣量為交換劑交換總量的1%-5%。
洗脫:已結合樣品的離子交換前,可通過改變溶液的pH或改變離子強度的方法將結合物洗脫,也可同時改變pH與離子強度。為了使複雜的組份分離完全,往往需要逐步改變pH或離子強度,其中最簡單的方法是階段洗脫法,即分次將不同pH與離子強度的溶液加入,使不同成分逐步洗脫。由於這種洗脫pH與離子強度的變化大,使許多洗脫體積相近的成分同時洗脫,純度較差,不適宜精細的分離。最好的洗脫方法是連續梯度洗脫,洗脫裝置見圖16-6。兩個容器放於同一水平上,第一個容器盛有一定pH的緩衝液,第二個容器含有高鹽濃度或不同pH的緩衝液,兩容器連通,第一個容器與柱相連,當溶液由第一容器流入柱時,第二容器中的溶液就會自動來補充,經攪拌與第一容器的溶液相混合,這樣流入柱中的緩衝液的洗脫能力即成梯度變化。第一容器中任何時間的濃度都可用下式進行計算:
C=C2-(C2-C1)(1-V)A2/A1
式中A1、A2分別代表兩容器的截面積:C1、C2分別表示容器中溶液的濃度;V為流出體積對總體積之比。當A1=A2時為線性梯度,當A1>A2時為凹形梯度,A1>A2時為凸形梯度。
洗脫時應滿足以下要求:①洗脫液體積應足夠大,一般要幾十倍於床體積,從而使分離的各峰不致於太擁擠。②梯度的上限要足夠高,使緊密吸附的物質能被洗脫下來。③梯度不要上升太快,要恰好使移動的區帶在快到柱末端時達到解吸狀態。目的物的過早解吸,會引起區帶擴散;而目的物的過晚解吸會使峰形過寬。
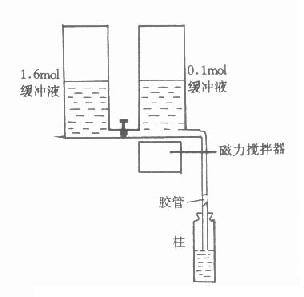
圖16-6 梯度洗脫示意圖
⒊洗脫餾份的分析 按一定體積(5-10ml/管)收集的洗脫液可逐管進行測定,得到層析圖譜。依實驗目的的不同,可採用適宜的檢測方法(生物活性測定、免疫學測定等)確定圖譜中目的物的位置,並回收目的物。
⒋離子交換劑的再生與保存離子交換劑可在柱上再生。如離子交換纖維素可用2mol/:NaCl淋洗柱,若有強吸附物則可用0.1mol/l NaOH洗柱;若有脂溶性物質則可用非離子型去污劑洗柱後再生,也可用乙醇洗滌,其順序為:0.5mol/l NaOH-水-乙醇-水-20%NaOH-水。保存離子交換劑時要加防腐劑。對陰離子交換劑宜用0.002%氯已定(洗必泰),陽離子交換劑可用乙基硫柳汞(0.005%)。有些產品建立用0.02%疊氮鈉。
⒌離子交換層析的應用離子交換層析技術已廣泛用於各學科領域。在生物化學及臨床生化檢驗中主要用於分離胺基酸、多肽及蛋白質,也可用於分離核酸、核苷酸及其它帶電荷的生物分子。
(三)高效液相層析法
高效液相層析法(HPLC)是近二十年來發展起來的一項新穎快速的分離技術。它是在經典液相層析法基礎上,引進了氣相層析的理論具有氣相層析的全部優點。由於HPLC分離能力強、測定靈敏度高,可在室溫下進行,應用範圍極廣,無論是極性還是非極性,小分子還是大分子,熱穩定還是不穩定的化合物均可用此法測定。對蛋白質、核酸、胺基酸、生物鹼、類固醇和類脂等尤為有利。
高效液相層析法的基本概念和分離理論與經典的液相色譜法及氣相色譜法一致,因而其塔板理論及動力學理論等都可用於高效液相層析。
⒈高效液相層析儀典型的高效液相層析儀包括輸液系統、層析柱與檢測系統三部分。流動相用一高壓泵輸入。這種高壓泵應滿足以下條件:①流量恆定,無脈動,並有較大的調節範圍。②能抗溶劑腐蝕。③有較高的輸出壓力,一般要達到15~300kg/c,也有的高達800kg/c。④泵的死體積要小。梯度洗脫裝置必須具備兩台高壓泵,一台輸送強溶劑,一台輸送弱溶劑,兩泵運轉速度用電腦控制,並可按一定的要求改變流動相的組成,以改善分離效果。一般用微量注射器直接進樣,也可採用六通閥門進樣。HPLC中所用的檢測器最多應用的是紫外吸收檢測,靈敏度可達ng水平。此外,還有熒光檢測器、示差析光檢測器、電化學檢測器等。
⒉HPLC的類型與應用
⑴液-固吸附層析:固定相是具有吸附活性的吸附劑,常用的有矽膠、氧化鋁、高分子有機酸或聚醯胺凝膠等。液-固吸附層析中的流動相依其所起的作用不同,分為「底劑」和洗脫劑兩類,底劑起決定基本色譜的分離作用,洗脫劑起調節試樣組份的滯留時間長短,並對試樣中某幾個組份具有選擇性作用。流動相中底劑與洗脫劑成分的組合和選擇,直接影響色譜的分離情況,一般底劑為極性較低的溶劑,如正已烷、環已烷、戊烷、石油醚等,洗脫劑則根據試樣性質選用針對性溶劑,如醚、酯、酮、醇和酸等。本法可用於分離異構體、抗氧化劑與維生素等。
⑵液-液分配層析:固定相為單體固定液構成。將固定液的官能團結合在薄殼或多孔型矽膠上,經酸洗、中和、乾燥活化、使表面保持一定的矽羥基。這種以化學鍵合相為固定相的液-液層析稱為化學鍵合相層析。另一種利用離子對原理的液-液分配層析為離子對層析。化學鍵合層析分:①極性鍵合相層析:固定相為極性基團,氰基、氨基及雙羥基三種。流動相為非極性或極性較小的溶劑。極性小的組份先出峰,極性大的後出峰,這稱為正相層析法,適用於分離極性化合物。②非極性鍵合相層析:固定相為非極性基團,如十八烷基(C18)、辛烷基(C8)、甲基與苯基等,流動相用強極性溶劑,如水、醇、乙腈或無機鹽緩衝液。最常用的是不同比例的水和甲醇配製的混合溶劑,水不僅起洗脫作用還可掩蓋載體表面的矽羥基,防止因吸附而至的拖尾現象。極性大的組份先出峰,極性小的組份後出峰,恰好與正相法相反,故稱反相層析。本法適用於小分子物質的分離,如肽、核苷酸、糖類、胺基酸的衍生物等。離子對分配層析分:①正相離子對層析:此法常以水吸附在矽膠上作為固定相,把與分離組份帶相反電荷的配對離子以一定濃度溶於水或緩衝液塗漬在矽膠上。流動相為極性較低的有機溶劑。在層析過程中,待分離的離子與水相中配對離子形成中性離子對,在水相和有機相中進行分配,而達到分離。本法優點是流動相選擇餘地大,缺點是固定相易流失。②反向離子對層析:固定相是疏水性鍵合矽膠,如C18鍵合相,待分離離子和帶相反電荷的配對離子同時存在於強極性的流動相中,生成的中性離子對在流動相和鍵合相之間進行分配,而得到分離。本法優點是固定相不存在流失問題、流動相含水或緩衝液更適用於電離性化合物的分離。
⑶離子交換層析:原理與普通離子交換相同。在離子交換HPLC中,固定相多用離子性鍵合相,故本法又稱離子性鍵合相層析。流動相主要是水溶液,pH值最好在被分離酸、鹼的pK值附近。
(四)親和層析法
親和層析是利用待分離物質和它的特異性配體間具有特異的親和力,從而達到分離目的的一類特殊層析技術。
具有專一親和力的生物分子對主要有:抗原與抗體、DNA與互補DNA或RNA、酶與它的底物或競爭性抑制劑、激素(或藥物)與它們的受體、維生素和它的特異結合蛋白、糖蛋白與它相應的植物凝集素等。可親和的一對分子中的一方以共價鍵形式與不溶性載體相連作為固定相吸附劑,當含有混合組份的樣品通過此固定相時,只有和固定相分子有特異親和力的物質,才能被固定相吸附結合,其它沒有親和力的無關組份就隨流動相流出,然後改變流動組成份,將結合的親和物洗脫下來。親和層析中所用的載體稱為基質,與基質共價連接的化合物稱配基。
親和層析純化過程簡單、迅速,且分離效率高。對分離含量極少又不穩定的活性物質尤為有效。但本法必須針對某一分離對象,製備專一的配基和尋求層析的穩定條件,因此親和層析的應用範圍受到了一定的限制。
親和層析可用於純化生物大分子:稀溶液的濃縮;不穩定蛋白質的貯藏;從純化的分子中除去殘餘的污染物;用免疫吸附劑吸附純化對此尚無互補配體的生物大分子;分離核酸是親和層析應用的一個重要方面。
應用實例:2-胰凝乳蛋白酶的提純
⒈親和吸附劑(Σ-氨基-N-乙醯-D-色氨酸)的製備取一定體積的Sepharose4B加100mgCNBr。攪拌混合物,滴加2-8mol/l NaOH,使溶液pH維持在11.0。20℃左右,8-12分鐘完成反應。在布氏漏斗中抽濾活化的瓊脂糖,然後用20倍體積冷的0.1mol/l NaHCO3(pH9.0)溶液洗滌。將上述活化的Sepharose4B與等體積0.1mol/l NaHCO3(pH9.0並在冰箱中預冷)溶液混合,接著迅速加入α-胰蛋白酶抑制劑(Σ-氨基-N-乙醯-色氨酸甲酯)。抑制劑的最大用量為每毫升Sepharose 4B 65μmol/L。4℃緩慢攪拌約24小時,而後再用水和緩衝液反覆地洗至沒有游離的抑制劑為止。製得的親和吸附劑在50mmol/l Tris-HCl緩衝液(pH8.0)中保存備用。
⒉分離 親和吸附劑裝柱後用50mmol/LTris-HCl(pH8.0)緩衝液平衡(室溫)。樣品溶於同樣緩衝液中並上柱,再應用同樣緩衝液淋洗柱子。流速為30-60ml/小時,直至280nm無光吸收時停止洗滌,然後改用0.2mol/L醋酸緩衝液(pH3.0)洗脫。
(五)聚焦層析法
聚焦層析是一種操作簡單、廉價的層析技術。它的原理是根據各種蛋白質的等電點不同進行分離的過程,因此本方法具有高分辨、高度濃縮和高度專一等特點。聚焦層析所用的凝膠首先用高pH溶液平衡,然後用多元緩衝液進行洗脫,多元緩衝液pH呈梯度下降。
聚焦層析所用凝膠主要有兩種:MONOP和多元緩衝液交換劑(PBE)。其中MONOP是帶孔小珠,孔中被帶正電荷的胺基填充,適用於高效聚焦層析。多元緩衝液交換劑是一種交換凝膠,適用作普通聚焦層析的介質。各種凝膠性質見表16-8。
表16-8 聚焦層析技術數據
| 凝膠名稱 | pH範圍 | 洗脫 |
| MONOP | 11-8 | Pharmalyte 8-10.5 |
| PBE | 11-8 | Pharmalyte 8-10.5 |
| MONOP | 9-6 | 多元緩衝液96 |
| PBE 94 | 7-4 | 多元緩衝液74 |
| PBE94 | 7-4 | 多元緩衝液74 |
NONOP可製成兩種高效液相柱:MONOp HR5/5(1ml),和MONOp HR5/20(5ml)。使用時根據樣品複雜性選擇相應的柱。HR5/5解析度為pI>0.2,HR5/20pI>0.02。
多元緩衝液交換劑PBE,屬珠狀交換劑凝膠,有PBe 118(pH11-8)和PBE(pH9-4)。在聚焦層析時,通過使用不同的洗脫液,可使交換容量發生改變,並且使pH達到更廣的範圍。
| 關於「臨床生物化學/層析法實驗技術」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |