肺泡蛋白質沉積症
| A+醫學百科 >> 肺泡蛋白質沉積症 |
肺泡蛋白質沉積症(pulmonary alveolar proteinosis,簡稱PAP),又稱Rosen-Castle-man-Liebow症候群。以肺泡和細支氣管腔內充滿PAS染色陽性,來自肺的富磷脂蛋白質物質為其特徵。好發於青中年,男性發病約3倍於女性。病因未明,可能與免疫功能障礙(如胸腺萎縮、免疫缺損、淋巴細胞減少等)有關。粉塵尤以接觸矽塵的動物可引起PAP,故認為可能是對某些刺激物的非特異反應,導致肺泡巨噬細胞分解,產生PAS陽性蛋白質。
目錄 |
病因
病因未明,推測與幾方面因素有關:如大量粉塵吸入(鋁,二氧化矽等),機體免疫功能下降(尤其嬰幼兒),遺傳因素,酗酒,微生物感染等。而對於感染,有時很難確認是原發致病因素還是繼發於肺泡蛋白沉著症。例如巨細胞病毒,卡氏肺孢子蟲,組織胞漿菌感染等均發現有肺泡內高蛋白沉著。
雖然啟動因素尚不明確,但基本上同意發病過程為脂質代謝障礙所致。即由於機體內、外因素作用引起肺泡表面活性物質的代謝異常。到目前為止,研究較多的有肺泡巨噬細胞活力,動物實驗證明巨噬細胞吞噬粉塵後其活力明顯下降,而病員灌洗液中的巨噬細胞內顆粒可使正常細胞活力下降,經支氣管肺泡灌洗治療後,其肺泡巨噬細胞活力可上升。而研究未發現Ⅱ型細胞生成蛋白增加,全身脂代謝也無異常。因此目前一般認為本病與清除能力下降有關。
病理
肺大部分呈實變,胸膜下可見黃色或黃灰色結節,切面有黃色液體滲出。鏡檢示肺泡及細支氣管內有嗜酸PAS強陽性物質充塞,是Ⅱ型肺泡細胞產生的表面活性物質磷脂與肺泡內液體中的其它蛋白質和免疫球蛋白的結合物,肺泡隔及周圍結構基本完好。電鏡可見肺泡巨噬細胞大量增加,吞噬肺表面活性物質,胞漿腫脹,呈空泡或泡沫樣外觀。
臨床表現
發病多隱襲,典型症状為活動後氣急,以後進展至休息時亦感氣急,咳白色或黃色痰、乏力、消瘦。繼發感染時,有發熱、膿性痰。少數病例可無症状,僅X線有異常表現。呼吸功能障礙隨著病情發展而加重,呼吸困難伴紫紺亦趨嚴重。
胸部X線表現為從兩側肺門向外放散的彌散性邊緣模糊細小結節陰影,常融合成片狀,病灶之間有代償性氣腫或形成小透亮區。
診斷
主要根據支氣管肺泡灌洗物檢查或經纖支鏡或剖胸活檢作出病理診斷。咳出的痰經80%乙醇固定,PAS染色有15%陽性的脂質。
診斷依據:
少數病例可無症状,僅X線有異常表現。呼吸功能障礙隨著病情發展而加重,呼吸困難伴紫紺亦趨嚴重。
治療
主要針對如何清除沉著於肺泡內蛋白樣物質。近年來用雙腔氣管導管(Carlen導管)或纖支鏡作一側肺或肺葉的生理鹽水灌洗,定期交替進行。近期療效顯示患者呼吸困難和肺功能均有改善,半數患者X線胸片可變清晰。遠期效果則多數保持緩解狀態,少數患者複發,常在6-24個月內,可再作肺灌洗。
肺泡蛋白沉著症(Pulmonary alveolar proteinosis,PAP)是一少見呼吸病,以肺泡及終末呼吸性細支氣管內沉著大量的表面活性蛋白及脂質為特徵。根據發病,可將其分為原發性PAP 與繼發性PAP兩類。繼發性PAP的治療原則為治療原發病。
對於原發PAP,明確有效的治療方法是支氣管肺泡灌洗,即通過灌洗清除肺泡內沉著的蛋白質和脂質。其效果取決於肺灌洗量,分次單側全肺盥洗較纖支鏡盥洗效果好。然而,當患者肺功能嚴重損害時則無法接受這一治療方法。其原因是盥洗一側肺內很少有可交換的氣體,結果引起低氧血症甚至呼吸衰竭。雖然可選擇體外循環或在高壓氧艙進行全肺灌洗,但會增加費用和併發症,也不便於操作。此外,灌注結束時肺內殘留的液體可達0.5-1.0升,需2-3天才能吸收乾淨,也會影響患者呼吸功能。
為克服這些不足,自1999年始試用了自己改良的全麻密閉加壓給氧分側肺盥洗術,與以往方法的差別是新方法中有2個重要的改良:1、肺盥洗時給予密閉加壓給氧。向肺內灌注生理鹽水至單側肺總量後,手動擠壓給氧同時保持呼氣末正壓5厘米水柱,使其中純氧和肺泡內盥洗液充分混合30-60次後再回收盥洗液。2、在首次和結束前的兩次盥洗液中,均在生理鹽水盥洗液中加入腎上腺素(1mg/L)。
第一個改良有三個有益作用:(1)使盥洗液與肺泡充分接觸,增加盥洗效果;(2)改善氧合功能,特別適合單側肺通氣不能保持氧分壓在安全範圍者。因為它可以使純氧混合在液體中,充分與肺泡接觸而增加氧合。如果術中氧飽和度降低,除調整非盥洗肺的吸氧濃度和呼吸支持參數外,還應增加盥洗肺側的給氧擠壓時間。(3)在盥洗肺側加壓給氧的同時,可由於肺泡內壓的升高而減少分流量和改善動脈血氧分壓。第二個改良的有益作用是在生理鹽水盥洗液中加入腎上腺素後,不但有利於舒張支氣管和回收盥洗液;而且有利於吸收肺泡內殘留液體,減少其對呼吸功能的影響。
目前新方法已經應用到少數的患者,均取得了明顯的效果。
相關資料
肺泡蛋白沉積症(pulmonary alveolar proteinosis'pap)是一種罕見的肺部疾病,病因不明,臨床表現以活動後氣促、咳嗽、咳少量白色黏液痰為主,無特徵性,極易誤診[1],診斷主要依賴於病理學檢查。多層ct(msct)的問世,使單次屏氣時間內完成高質量的全肺薄層掃描成為現實,極大提高了圖像的時間和空間解析度,胸部高解析度ct(hrct)還能清晰顯示次級肺小葉為單位的肺內細微結構,極大提高了ct在肺部疾病診斷中的應用價值。本文收集經病理證實的6例pap,綜合國內外有關文獻 ,探討pap的影像病理學聯繫及其多層ct表現特徵,旨在提高對本病的認識和診斷。
1 資料與方法
1.1 一般資料
收集2000年1月~2005年6月經病理學證實的6例pap患者作為研究對象。男4例,女2例,年齡25~55歲,平均42歲。病程7個月~10.3年,其中1例有粉塵接觸史5年。臨床症状包括:氣促(6例)、咳嗽咳痰(5例)、胸痛(2例)、痰中帶血絲(1例)及發熱(1例)。體格檢查: 2例無明顯陽性體征;4例出現雙下肺濕囉音;杵狀指1例;紫紺1例。
1.2 影像學檢查
採用ge lightspeed qx/i多層ct掃描機,常規行胸部ct平掃及增強掃描,範圍自肺尖掃至肺底。掃描參數:層厚5mm,螺距6∶1,床速15mm/s,管電流210ma,管電壓120kv。增強掃描所用對比劑為碘帕醇(300mgi/ml),經高壓注射器給藥,劑量80ml,注射流率2.5ml/s,給藥開始後32s進行增強掃描。其中4例同時進行病變區hrct掃描,掃描參數:管電流250ma,管電壓120kv,層厚1.25mm,間隔1mm,骨演算法重建。
1.3 組織病理學檢查
6例患者均在多層ct檢查後接受支氣管肺泡灌洗(bal)及經支氣管肺活檢(tblb)'其中2例因tblb未確診再行經皮肺穿刺活檢明確診斷。bal液(balf)沉澱物及活檢肺組織行he染色、過碘酸雪夫(pas)染色及奧辛藍(ab)染色,在光學顯微鏡下觀察。
1.4 影像學評價
採用單盲法由從事影像診斷的教授1名,主治醫師2名,分析6例患者的多層ct平掃及增強表現,以活檢結果為對照,探討pap的影像病理學聯繫及其多層ct表現特徵。
2 結果
2.1 多層ct表現
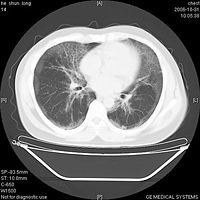
本組共6例經病理學證實為pap患者,其多層ct診斷結果分別為:特發性肺間質纖維化2例;浸潤型肺結核1例;肺泡癌1例;肺炎1例;肺泡蛋白沉積症1 例,診斷正確率17%。6例患者均見雙肺散在分布的毛玻璃樣高密度影,密度欠均勻,形態呈三角形、方形和多邊形,少數呈圓形、弧形或線形,全部病灶邊界清楚。其中4例可見部分病灶融合呈片塊狀。所有患者病變分布以肺門區及肺野外帶為主,上下肺葉均可見到,在周圍正常肺組織襯托下。4例患者的hrct圖像還可見到在斑片狀毛玻璃影中增多、增粗、紊亂的肺小葉間隔,呈鋪路石樣(crazy paving appearance)表現[4'5],見圖2。病變與周圍肺組織分界清楚,相鄰肺組織未見明顯異常表現。本組所有病例未見支氣管氣像,msct增強掃描均未見病灶強化以及縱隔或肺門淋巴結腫大徵象。心臟大小形態在正常範圍。
2.2 病理學表現
病理學發現此6例患者肺泡腔內充滿大量粉紅色雲絮狀、無定形蛋白樣物質。4例患者病變區內見小葉間隔水腫、增厚,可見淋巴細胞浸潤。所有患者肺泡間隔無明顯纖維組織增生以及肺泡結構未見破壞。全部病例肺灌洗均可見乳白色牛奶樣混濁液,3例可見沉澱物。全部病例過碘酸雪夫(pas)染色均為陽性,奧辛藍(ab)染色均為陰性。
3 討論
肺泡蛋白沉積症臨床非常罕見,由rosen等[6]於1958年首先報導,其病因及發病機制至今仍不清楚, 目前認為與肺泡表面物質代謝異常或肺泡巨噬細胞的清除異常有關,部分患者還可能與粉塵或某些化學物質吸入所致的特異性反應有關,也可能與自身免疫機制障礙、血液和淋巴系的惡性腫瘤以及細胞毒性藥物的應用有關3.1 影像與病 理學 聯繫 肺泡腔內充滿大量粉紅色雲絮狀或細顆粒狀無定形蛋白質樣物質為pap的主要病理改變,而肺泡壁、支氣管壁和胸膜病變不明顯。病變區與相鄰正常肺組織界限清楚,肺泡結構保持完整,肺泡間隔多數正常,少數可因間隔水腫及淋巴細胞浸潤而增厚[8]。病變 發展的不同階段,肺泡蛋白沉積症出現不同的影像學徵象。當病變僅累及肺泡腔,以蛋白質樣物質充填肺泡腔為主,而肺泡間隔無水腫及炎症細胞滲出時,ct檢查可見肺野內毛玻璃樣斑片狀高密度影,病變與周圍正常肺組織形成明顯分界,在肺野中呈地圖樣表現[2'3]。本組所有患者均可見此徵象。其形成機制尚不明確,可能與病變分布以肺小葉為單位,小葉間隔在一定程度上限制了病變蔓延有關。根據 文獻,即使做過肺灌洗的患者,其剩餘的肺實變仍然邊界清楚[5]。msct增強掃描病灶未見強化,說明病灶缺乏血供及無肉芽組織形成。當病變累及小葉間隔,小葉間隔因水腫及炎症細胞浸潤而增厚時,hrct上可見實變區出現增厚的小葉間隔,圍繞實變的肺小葉形成鋪路石樣表現,具有一定的特徵性[4'5]。本組4 例患者見此徵象。hrct能夠清楚地顯示pap患者的次級肺小葉結構,發現胸部x線平片及常規ct所不能發現的pap患者肺小葉及小葉間隔病變,從而更好地評定病變範圍及嚴重程度,具有重要價值。本組中hrct圖像顯示pap患者增粗的肺紋理符合小葉間隔走行,與肺部纖維化表現不同,病理學上pap患者的小葉間隔也無纖維化改變發生。pap病變分布以雙肺多見,可僅累及一側[9],肺野中央及外周均可發生,上下肺分布無明顯差異[3'9'10]。文獻報導當實變肺泡與含氣肺泡混雜並存時,還可見到實變陰影內出現蜂窩狀透光區,但是支氣管氣像不多見[9]。本組病例中均未見。肺泡蛋白沉積症為非感染病變,部分學者認為該病不伴有縱隔、肺門淋巴結腫大,若出現明顯淋巴結腫大則多數與感染有關[11]。本組所有病例均未見到縱隔、肺門淋巴結腫大。
總之,對於肺部瀰漫性病變,ct表現為地圖樣及鋪路石樣時,高度提示pap診斷。胸部ct掃描特別是hrct能提高對pap的早期正確診斷。[4'7'8]。本病好發於30~50歲成人,偶見於兒童及老年患者,男性多於女性。多數患者起病隱襲,臨床表現無特徵性,常見症状為活動後氣促、咳嗽、咳少量白色黏液痰,亦可為乾咳無痰。低熱、乏力、胸痛、咯血者少見,部分病例可咯出小塊膠凍樣物質。部分患者體格檢查可聞及少許肺底部濕囉音,約1/5患者出現杵狀指,重者可致發紺。患者預後差異大,部分可自行緩解,複發常見,約1/3患者因呼吸衰竭或合併感染而死亡。
參考
| 關於「肺泡蛋白質沉積症」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |