基礎檢驗學/血紅蛋白測定
| 醫學電子書 >> 《臨床基礎檢驗學》 >> 血液學檢查 >> 血液一般檢查 >> 紅細胞檢查 >> 血紅蛋白測定 |
| 臨床基礎檢驗學 |
|
|
(一)血紅蛋白分子結構及成分
血紅蛋白是在人體有核紅細胞及網織紅細胞內匐成的一種含色素輔基的結合蛋白質。色素部分是亞鐵血紅素,蛋白質部分是珠蛋折,血紅素是由原卟啉和鐵原子組成的一種結合物,亞鐵原子的六個配位鍵中的四個與原卟啉的四個吡咯壞的氮原子相邊,一個與珠蛋白的肽鏈F肽段第八個胺基酸------組氨酸的咪唑基相邊,另一個鍵則可逆性地與氧結合,完成運氧功能。當各種原困使Fe2+氧化成Fe3+即喪失攜氧功能。與一切蛋白質結構一樣,Hb的珠蛋白部分是由兩條α鏈(α鏈及胚胎時的ξ鏈)和兩條非α鏈(β鏈、γ鏈、δ鏈及胚胎時的ε鏈)組成。α鏈由141個胺基酸組成,β鏈由146個胺基酸組成。兩對肽鏈聚合成四聚體、即Hb分子,亞鐵血紅素結構見圖2-2。
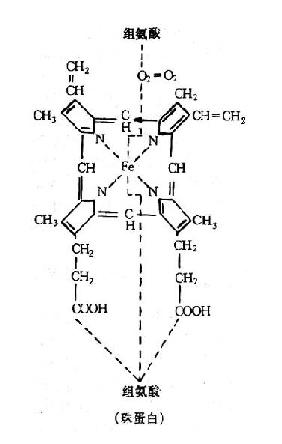
圖2-2 亞鐵血紅素結構式
Hb的合成受激素的調節,影響Hb合成的激素有兩種.一種是紅細胞生成素,可促δ-氨基-γ酮戊酸(ALA)生成與鐵的利用,從而促進血紅素和Hb 二是雄激素,睾酮在肝臟內由5-β還原酶轉變為5-β氫睾酮,它能促進ALA合成酶的生成.雄激還能促進紅細胞生成素的生成,直接和間接促進Hb的合成.當血紅素合成過多時,血紅素自發氧化為高鐵血紅素,高鐵血紅素對ALA合成酶有直接抑制作用,關能阻遏ALA合成酶生成,進而減少血紅素的合成.
在人體不同生長時期Hb種類與比例不同.在胚胎髮育早期,大約於妊娠第5周,ζ與ε基因即表達於卵黃囊的成紅細胞中,形成了人個體發育中第一個有功能的胚胎期血紅蛋白四聚體ζ2ε2(HbGower I)在妊娠第6 周,成紅細胞開始由卵黃囊游移到肝臟,此時ζ表達水平顯著降低,α和γ基因開始表達,由這些肽鏈組成3種胚胎期血紅蛋白,好Hb GowerI(ζ2ε2),Hb GowerⅡ(α2ε2),HbPortland(ζ2γ2)和一種胎兒血紅蛋白HbF(α2γ2),到胚胎髮育第8周,ζ和ε鏈逐漸消失,γ鏈合成達到最高峰,而且開始有β鏈合成,即有成人血紅蛋白HbA(α2β2)產生。36周後β鏈合成迅速增加,γ鏈合成速率降低,出生後不久可見β與γ鏈合成大致等量,生後3個月由於鏈合成繼續增加,而γ鏈合成迅速降低而至HbA占絕對優勢,逐步佔95%以上。而HbA逐步下降到小於等於1%。δ鏈開始合成的確切時間不很清楚,由於臍帶血中存在微量的δ鏈,說明它在胎兒時期已經開始合成,出生後佔Hb總量的2%-3%。成有血紅蛋白按不攜氧計算分子量為64458。
在正常狀態機體有99%Hb的鐵原婦呈Fe2+狀態,稱為還原Hb ,1%o Fe3+為高鐵血紅蛋白只有亞鐵狀態的Hb才能與氧結合,此時稱氧合血紅蛋白。一氧化碳與可以與Hb結合碳氧血紅蛋白且其結合力高於氧結合力210倍,如果HbO2在含人有苯肼和硫化氫的環境中即轉變為硫化血紅蛋白。SHb常可出現在服用阿司匹林和可等待困患者血中。
(二)氰化高鐵積壓紅蛋白測定法
自從1875年Gower設計了稀釋溶血液目測比色法以來,血液學工作者對Hb測定進行了大量探討,大致分為①根據Hb分子組成測定總Hb法(全血鐵法);②根據血液物理物性測Hb(比重法、折射儀法);③根據Hb與O2可逆性結合的物性測Hb(血氣分折法)和④根據Hb衍生物光譜特點進行的定量測定法等四大類,其中有些方法簡單易行,而得到長期廣泛應用(如沙利法),但隨著技術的進步和研究的深入,缺點日漸顯著,逐漸被淘汰。為統一Hb測定方法,1966年國際血液學標準化委員全推薦氰化高鐵血紅蛋白測定法作為國際Hb測定標準法。1978年國際臨床化學聯合會和世界病理學會聯合會發表的國際性文件中重申了HICN法。
[原理] 血液在血紅蛋白轉化液中溶血後,除SHb外各種血紅蛋白均可被高鐵氰化鉀氧化高鐵血紅蛋白,再與CN-結合生成穩定的棕紅色氰化高鐵積壓紅蛋白。HICN最大吸收波峰在540nm,最小吸收谷為504nm。特定標準條件下,毫摩爾消光係數為44L.mmol-1.cm.因此根據標本的吸光度,即可救是血紅蛋白濃度。HICN吸收光譜曲線特點見圖2-3。
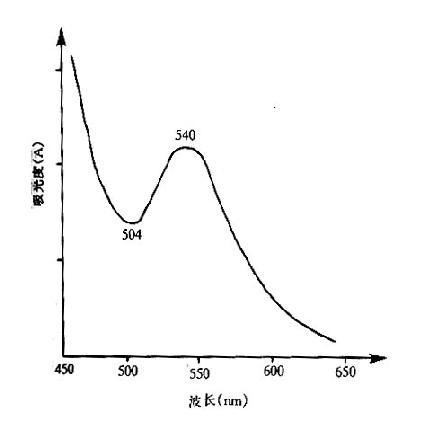
圖2-3 氰化高鐵血紅蛋白光譜吸收曲線
在沒有符合WHO標準的分光光度計的條件下,亦可用HICN參考液制標準曲綞,或耱出換算常數,間接計算血紅蛋白濃度(g/l)。
[方法學評價] HICN法具有操作簡單、顯色快且穩定(顯色後如保存得當可六年不退色),除SHb外各種血紅蛋白均可檢測、讀取吸光度後可直接定值等優點。
HICN的消光係數是44mmol-1.cm-1。可根據下式進行計算:
A/44×64458(mg)/1000×251=A×367.7=Hb(g/l)
式中A 是在540nm處HICN吸光度,64458mg是Hb 的毫克分子量,1000是將毫克轉換為克,251是實驗時血液的稀釋倍數。但使用367.7這處常數是有條件的,是基於在儀器,比色杯,試劑及操作均嚴格的要求下,才能直接使用。儀器的校正是測定的關鍵,決定著測定結果的準確與否。在實際工作中,使用的分光光度計很難達到上述要求,往往通過K值來校正結果,定期地檢查K值十分重要。HICN法被列為國際血紅蛋白測定的參考方法。HICN法逐漸在國內普及,對Hb測定的標準化起了一定作用,但在實際應用中尚存在一些問題,關非理想的方法。其致命點是KCN有劇毒,使用管理不當可造成公害,此外高白細胞和高球蛋白血症可致混濁,以及HbCO轉化較慢的問題也未完全解決。
實際工作中,多採用替代方法進行Hb測定,將其結果校下在到HICN法水平。國內多採用十二烷基硫酸鈉血紅蛋白測定法,其原理是,除SHb外,血液中各種Hb均可與低濃度SDS作用,生居SDS-Hb棕紅色化合物。其吸收曲線波峰在538nm,小組谷在500nm 肩峰在560nm。由於摩爾消光係數尚未最後確認,因此不能用吸光度A直接計算Hb濃度。本法可用HICN法定值的抗凝血或溶血液,製備標準工作曲線,間接計算血紅蛋白濃度本法的優點是操作簡單,呈色穩定,準確性和精確性符合要求無公害,在全國臨床檢驗方法學學術會議上,被推薦為次選方法。但SDS本身質量差異較大且SDS破壞白細胞,不適於同時蛤有計數白細胞和Hb定量兩種功能和血細胞分析儀使用。
疊氮高鐵血紅蛋白測定法具有與HICN相似的優點,最大吸收峰在542nm,且峰值高度幾乎與HICN者重合,文獻報導HICN與HIN3兩者結果回歸方程的截距僅為0.013或為0,實驗時顯色快且穩定。試劑毒性僅為HICN者的1/7,至今仍有人用於臨床,但仍存在公害問題。
Zander(1984)年提出鹼羥血紅蛋白(AHD575)測定法,575nm為其檢出波長。該法試劑簡單,不含有毒劑。呈色穩定,可用氯化血素作標準品,已被許多單位採用。但由於自動積壓細胞分析儀或血紅蛋白測定儀多採用540nm左右範圍濾光板(圖為HICN最大吸收峰在540nm),限制了此法在該類儀器的使用。
沙利酸化血紅蛋白測定法。雖操作簡單但誤差較大,已被列為縣以上醫院淘汰的實驗項目。
近年來,多參數血細胞公析儀的應用,使Hb測定逐步以儀器法取代手工法,其優點是操作簡單、快速,同時可以獲得多項紅細胞的參數,但由於各型號儀器使用的溶血劑不同,形成Hb的衍生物不同。某些溶血劑形面的衍生物穩定性較差(如2%十六基三甲基溴化銨),因此要嚴格控制血劑加入量及溶血時間,特別半自動血細胞分析儀嚴格控制實驗條件。有些溶血劑內雖加入了KCN,但其衍生拖把關非是HICN,儀器要經過HICN標準液校正後,才能進行Hb測定。
參看
| 關於「基礎檢驗學/血紅蛋白測定」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |