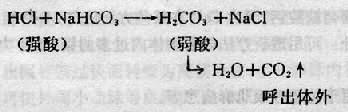病理生理學/正常平衡的調節
| 醫學電子書 >> 《病理生理學》 >> 酸鹼平衡紊亂 >> 正常平衡的調節 |
| 病理生理學 |
|
|
在正常情況下,人體血漿pH值平均為7.4,變動範圍很小(pH7.35~7.45)。而機體每日代謝產酸量是很大的,例如,非揮發酸可達50~100毫克當量,CO2可達400升。這些酸性物質必須及時處理,否則血漿pH值不能保持正常。這就靠一整套調節機構密切協同來完成。
目錄 |
一、化學緩衝物質的作用(化學反應可以瞬間完成)
血液中有一系列緩衝物質。根據化學上的緩衝作用原理,我們人為地把它們歸納為四個主要的緩衝對,即NaHCO3/H2CO3,Na2HPO4/NaH2PO4,B.血漿蛋白/H.血漿蛋白,B.Hb/H.Hb。它們具有很強且很迅速的緩衝酸鹼度改變的能力。例如,我們將10mmol(毫克分子)的HC1加1000毫升中性蒸餾水中,其pH值可從7降至2,但同量酸加於1000毫升血漿中,其pH值的變化卻很小,以致一般幾乎測不出來。
每一對緩衝物質既能緩衝酯也能緩衝鹼,其中以NaHCO3/H2CO3這一對最為重要,因為它的量最大。它對酸的緩衝區反應如下:
從上面的反應可以看出,經NaHCO3緩衝,解離度大的強酸HC1轉變為解離度小的弱酸H2CO3,後者在體液中的解離度僅約為前者的1/1500。因此使[H+]大為減小。而且H2CO3還能分解為H2O和CO2,CO2又能呼出體外。醫學實踐中將血漿中NaHCO3稱為鹼貯備,以二氧化碳結合力表示之。正常值為27mmol(或毫克當量)/升或60容積%。
二、離子轉移(一般在2~4小時完成)
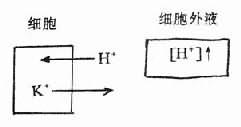
這也是緩衝方式之一。當能改變酸鹼平衡的離子如H+、HCO3-等在細胞外液中升高時,它們能進入細胞內(或進入骨內)換出與其符號相同的離子,以保持細胞外液之pH值。其變化可簡單表示如下:
進入細胞內的H+可與細胞內的化學緩衝物質起化學反應而被緩衝。根據實驗研究估算,酸或鹼在細胞外液增加後,一般約經2~4小時,將有1/2的量進入細胞內。所以儘管細胞內液量大於細胞外液量一倍,但二者化學緩衝總能力卻大致相等,可見細胞外液中緩衝物質的濃度是高於細胞內液的。
這個事實對治療有關。舉一代謝性酸中毒病人用NaHCO3治療時的情況為例:
病人體重=60公斤
細胞外液量=0.20×60=12升
治療前血漿[HCO3-]=13mmo1(或毫克當量)/升
給NaHCO3量=100mmo1
病人治療後實測血漿[HCO3-]=16.7mmol/升
實踐證明,上述規律是較為可靠的。因此在糾正酸鹼中毒時應考慮離子轉移這一變化。計算輸液量時要將這一變化估計在內。
三、呼吸調節
呼吸調節(一般10~30分鐘即可將輕度的一次性變動代償過來)。[H+]增高和[CO2]增高,均能剌激呼吸中樞;H+還對頸動脈體和主動脈體的化學感受器起刺激作用,這都可引起呼吸加深加快,使CO2排出增加。從上面介紹的緩衝反應來看,每排出一個CO2分子,也就等於清除了一個H+離子,如:
H++HCO3-→+H2CO→H2C+CO2↑(增多) 鹼貯 (呼出)
四、腎臟調節
腎臟調節(數小時至數日完成):腎臟是酸鹼平衡調節的最終保證。因為只有CO2可以通過呼吸排出體外(CO2即可代表可揮發酸H2CO3,因為CO2+H2O→H2CO3),而其它如乳酸、丙酮酸、β-羥丁酸、乙醯乙酸、硫酸、磷酸、尿酸、草酸等均為非揮發酸,最終均需通過腎臟把前面三項調節所造成的變動調整過來。把過多的排出,把不足的保留下來。因此腎臟調節機體酸鹼平衡的功能正常與否,關係重大。
腎臟排酸有三種形式:
(一)自由H+:雖然它決定著尿液pH值,但是其量卻很少(每日只~2毫克當量)。尿pH為5時,[H+]為0.00001克分子,pH為8時,[H+]為0.0000000克分子。儘管它確是一種存在形式,它只是尿中大量酸性物質的一個很小部分。而腎臟排酸主要是以下二種形式。
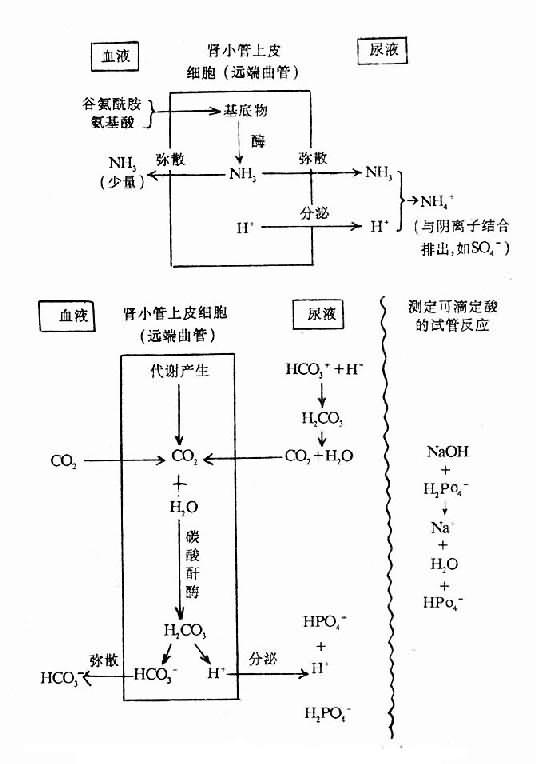
(二)NH4-:是H+與NH3作用形成的。NH3由腎小管產生,在體內是很強的鹼性物,與H+的親和力極大。它彌散至尿中與H+結合。示意如下:
人體每日由代射所產生的非揮發酸總量約50~100mmol,其中一半以上(1/2~2/3)是以此種形式排出的。
(三)可滴定酸:是由H+與緩衝物質(主要是HPO4=作用形成的。用NaOH把尿滴定至與血漿相同之pH,即可測知可滴定酸量。可滴定酸的形式約佔腎排酸總量的少一半(1/3~1/2)。
腎小管上皮細胞分泌的H+,在近曲小管幾乎全部用於重吸收HCO3-;在遠曲小管則幾乎全部用於生成可滴定酸和NH4+。這與腎臟疾病的代謝性酸中毒如腎小管性酸中毒的關係密切。可滴定酸的形成示意如下:
| 關於「病理生理學/正常平衡的調節」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |