生理學/骨骼肌的收縮機制和興奮-收縮耦聯
| 醫學電子書 >> 《生理學》 >> 細胞的基本功能 >> 肌細胞的收縮功能 >> 骨骼肌的收縮機制和興奮-收縮耦聯 |
| 生理學 |
|
|
|
Huxley等在50年代初期就提出了用肌小節中粗、細肌絲的相互滑行來說明肌肉收縮的機制。這一被稱為滑行理論(sliding theory)的主要內容是:肌肉收縮時雖然在外觀上可以看到整個肌肉或肌纖維的縮短,但在肌細胞內並無肌絲或它們所含的分子結構的縮短,而只是在每一個肌小節內發生了細肌絲向粗肌比之間的滑行,亦即由z線發出的細肌絲在某種力量的作用下主動向暗帶中央移動,結果各相鄰的z線都互相靠近,肌小節長度變短,造成整個肌原纖維、肌細胞乃至整條肌肉長度的縮短。滑行現象最直接的證明是,肌肉收縮時並無暗帶長度的變化,而只能看到明帶長度的縮短;並且與此同時也看到暗帶中央H帶相應地變窄。這只能說明,細肌絲在肌肉收縮時也沒有縮短,只是它們更向暗帶中央移動,和粗肌絲發生了更大程度的重疊。這種變化只能用粗、細肌絲之間出現了相對運動即滑行現象來解釋。滑行理論需要進一步說明的問題是:肌肉收縮時究竟是什麼力量促使細肌絲向粗肌絲之間滑行,以及怎樣把這些過程和肌肉膜的興奮過程聯繫起來。近年來,由於肌肉生物化學及其他細胞生物學技術的發展,肌絲滑行的機制已基本上從組成肌絲的蛋白質分子結構的水平得到闡明,對於與滑行的開始和終止有關的各種控制因素,也有了較較深入的了解。
(一)肌絲的分子組成和橫橋的運動
滑行現象的引起與組成肌絲的蛋白質分子結構和它們的特性有直接的關係。粗肌絲主要由肌凝蛋白(亦稱肌球蛋白)所組成,它們的分子在粗肌絲中呈獨特的有規則的排列。一條粗肌絲大約含有200~300個肌凝蛋白分子,每個分子長150nm,呈長桿狀而在一端有球狀膨大部。在組成粗肌絲時,各桿狀部朝向M線而聚合成束,形成粗肌絲的主幹,球狀部則有規則地裸露在M線兩側的粗肌絲主幹的表面,形成橫橋(圖2-21,左)。當肌肉安靜時,橫橋與主幹的方向相垂直,由粗肌絲表面突出約6nm。用X-線衍射法證明,橫橋在粗肌絲表面的分布位置也是嚴格有規則的,即在粗肌絲的同一周徑上只能有兩個相隔180°的橫橋突出;在與此周徑相隔14.3nm的主幹上又有一對橫橋突出,但與前一對有60°的夾角;如此反覆,到第四對橫橋出現時,其方向正好與第一對橫橋相平行,且與第一對橫橋相隔42.9nm(圖示-21,右)。上述橫橋的分布情況,正好與一條粗肌絲為6條細肌絲所環繞的情況相對應,亦即在所有橫橋出現的位置,正好有一條細肌絲與之相對;而對於每條細肌絲來說,粗肌絲表面每隔42.9nm就伸出一個橫橋與之相對(圖2-21)。這種對應關係,對於粗、細肌絲之間的相互作用顯然是十分有利的。
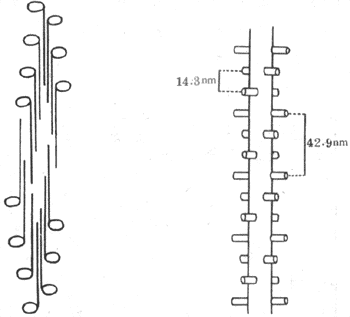
圖2-21 粗肌絲中肌凝蛋白分子的排列示意圖
左、肌凝蛋白分子的長桿狀部橫向聚合,形成粗肌絲主幹,球狀部裸露在表面,形成橫橋
右、橫橋在粗肌絲表面的幾何排列
現已證明,橫橋所具有的生物化學特性對於肌絲的滑行有重要意義。橫橋的主要特性有二:一是橫橋在一定條件下可以和細肌絲上的肌纖蛋白分子呈可逆性的結合,同時出現橫橋向M線方向的扭動,繼而出現橫橋和細肌絲的解離、複位,然後再同細肌絲上另外的點結合,出現新的扭動,如此反覆,使細肌絲繼續向M線方向移動;二是橫橋具有ATP酶的作用,可以分解ATP而獲得能量,作為橫橋擺動和作功的能量來源。由此可見,橫橋和細肌絲的相互作用,是引起肌絲滑行的必要條件。
細肌絲至少由三種蛋白質組成,其中60%是肌纖蛋白(亦稱肌動蛋白)。肌纖蛋白與肌絲滑行有直接的關係,故和肌凝蛋白一同被稱為收縮蛋白質。肌纖蛋白分子單體呈球狀,但它們在細肌絲中聚合成雙螺旋狀,成為細肌絲的主幹(圖2-22)。細肌絲中另外有兩種蛋白質,它們不直接參与肌絲間的相互作用,但可影響和控制收縮蛋白質之間的相互作用,故稱為調節蛋白質;其中一種是原肌凝蛋白,也呈雙螺旋結構,在細肌絲中和肌纖蛋白雙螺旋並行,但在肌肉安靜時原肌凝蛋白的位置正好在肌纖蛋白和橫橋之間(圖2-23,左)這就起了阻礙兩者相互結合的作用;另一種調節蛋白質稱為肌鈣蛋白(亦稱原寧蛋白),肌鈣蛋白在細肌絲上不直接和肌纖蛋白分子相連接,而只是以一定的間隔出現在原肌凝蛋白的雙螺旋結構之上。肌鈣蛋白的分子呈球形,含有三個亞單位(圖2-22):亞單位C中有一些帶雙負電荷的結合位點,因而對肌漿中出現的Ca2+(以及其他可能出現的兩價正離子和H+)有很大的親和力;亞單位T作用是把整個肌鈣蛋白分子結合於原肌凝蛋白;而亞單位I的作用是在亞單位C與Ca2+結合時,把信息傳遞給原肌凝蛋白,引起後者的分子構象發生改變,解除它對肌纖蛋白和橫橋相互結合的阻礙作用。
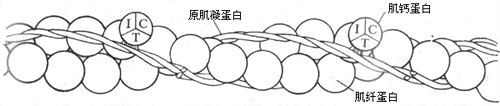
圖 2-22 細肌絲的分子組成
I、T、C分別代表肌鈣蛋白的三個亞單位
肌絲滑行的基本過程一般公認為:當肌細胞上的動作電位引起肌漿中Ca2+濃度升高時,作為Ca2+受體的肌鈣蛋白結合了足夠數量的Ca2+,這就引起了肌鈣蛋白分子構象的某些改變,這種改變「傳遞」給了原肌凝蛋白,使後者的構象也發生某些改變,其結果是使原肌凝蛋白的雙螺旋結構發生了某種扭轉,這就把安靜時阻止肌纖蛋白和橫橋相互結合的阻礙因素除去,出現了兩者的結合。在橫橋與肌纖蛋白的結合、扭動、解離和再結合、再扭動構成的橫橋循環過程中,使細肌絲不斷向暗帶中央移動;與此相伴隨的是ATP的分解消耗和化學能向機械能的轉換,完成了肌肉的收縮(圖示2-23)。
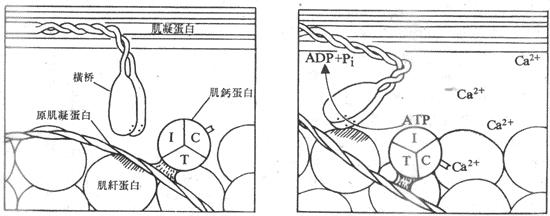
圖2-23 Ca2+通過和肌鈣蛋白的結合,誘發橫橋和肌纖蛋白之間的相互作用
上述的橫橋循環在一個肌小節以至整個肌肉中都是非同步地進行的,這樣才可能使肌肉產生恆定的張力和連續的縮短。至於能參與循環的橫橋數目以及橫橋循環的進行速率,則是決定肌肉縮短程度、縮短速度以及所產生張力的關鍵因素,這將在分析肌肉收縮的力學表現時再作討論。下面敘述正常條件下引發和終止橫橋循環的肌漿中Ca2+濃度的突然升高和快速下降是怎樣發生的。
(二)骨骼肌的興奮-收縮耦聯
在整體情況下,骨骼肌總是在支配它的軀體傳出神經的興奮衝動的影響下進行收縮的;直接用人工刺激作用無神經支配的骨骼肌,也可引起收縮。但不論何種情況,刺激在引起收縮之前,都是先在肌細胞膜上引起一個可傳導的動作電位,然後才出現肌細胞的收縮反應。這樣,在以膜的電變化為特徵的興奮過程和以肌絲的滑行為基礎的收縮過程之間,必然存在著某種中介性過程把兩者聯繫起來,這一過程,稱為興奮-收縮耦聯。目前認為,它至少包括三個主要步驟:電興奮通過橫管系統傳向肌細胞的深處;三聯管結構處的信息傳遞;肌漿網(即縱管系統)對Ca2+釋放和再聚積。
橫管系統對正常肌細胞的興奮-收縮耦聯是十分必要的。用含有甘油的高滲任氏液浸泡肌肉一段時間,再把它放回到一般任氏液中,這樣的處理可以選擇性地破壞肌細胞的橫管系統;這時如果再給肌肉以外加刺激,雖然仍可在完好的肌細胞膜上引起動作電位,但不再能引起細胞收縮。近年來證明,橫管膜和一般肌細胞膜有類似的特性,又是後者的延續部分,因而它也可以產生以Na+內流為基礎的膜的去極化甚或動作電位;當一般細胞膜因興奮而產生動作電位時,這一電變化可沿著凹入細胞內部的橫管膜傳導,深入到三聯管結構和每個肌小節的近旁。
實際測定還證明,肌肉安靜時肌漿中的Ca2+濃度低於10-7mol/L,但在膜開始去極化的很短時間內,可以在1~5ms內升高到10-5mol/L的水平,亦即增高100倍之多。這樣多的Ca2+由何而來?用放射性45Ca自顯影等技術證明,肌肉安靜時Ca2+主要停留和聚積在z線附近,相當於肌漿網的終末池部位;肌肉收縮時,Ca2+由這裡向暗帶區擴散,觸發橫橋循環。這樣問題就歸結為:當肌膜上的電變化沿橫管系統到達三聯管部分時,一定有某種因子把橫管膜上發生的變化傳遞給了相距不遠的肌漿網膜上的類似Ca2+通道的結構,引起後者分子的變構作用,使通道開放,於是肌漿網內高濃度的Ca2+就不需耗能而靠易化擴散進入肌漿,到達肌絲區。傳遞這一信號的因子,有人認為是橫管膜上存在的一種特殊蛋白,平時對肌漿網Ca2+通道外側開口有機械堵塞作用,但在橫管膜有電變化時發生變構作用,使原來的堵塞作用解除;也有人認為橫管膜可因電變化而產生了第二信使類物質IP3(見本章第二節),由後者作用於Ca2+通道使之開放。由於三聯管外有關的膜和膜中蛋白質幾乎可以相互接觸,因而第一種控制形式還是有可能的。
釋放到肌漿中的Ca2+怎樣被迅速除去,目前已證明是由於肌漿網膜結構中存在的一種特殊的離子轉運蛋白質即鈣泵活動的結果。鈣泵是一種Ca2+依賴式ATP酶,目前已被分離提純,它占肌漿網膜蛋白質總量的60%;在肌漿中Ca2+增高情況上,它可以分解ATP獲得能量,將Ca2+在逆濃度差的情況下由肌漿轉運到肌漿網內腔中去;由於肌漿中Ca2+濃度的降低,和肌鈣蛋白結合的Ca2+也解離,引起肌肉舒張。
| 關於「生理學/骨骼肌的收縮機制和興奮-收縮耦聯」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |