醫用化學/芳香烴
| 醫學電子書 >> 《醫用化學》 >> 環烴 >> 芳香烴 |
| 醫用化學 |
|
|
芳香烴科稱芳烴,它是芳香族化合物的母體。這裡所講的芳香烴是指分子中含有苯環的烴類。苯是最簡單最重要的芳香烴。
在芳香烴中,根據所含苯環數目的多少和連接方式,又可分為單環芳香烴和多環芳香烴兩類。
單環芳香烴:
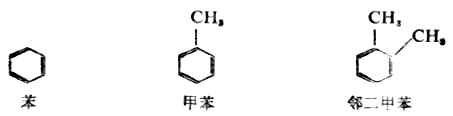
多環芳香烴:
分子中含有兩個或兩個以上的苯環,根據苯環的連接方式不同,又可分為三類:
多苯代脂烴這類芳香烴可看作是脂肪烴中兩個或兩個以上氫原子被苯取代的化合物,如二苯甲烷、三苯甲烷等。

聯苯和聯多苯分子中兩個或兩個以上的苯環直接互相連接,如聯苯、多聯苯等。

稠環芳香烴苯環通過共用相鄰的碳原子相互稠合而成的芳香烴稱為稠環芳香烴。如萘、蒽、菲等。
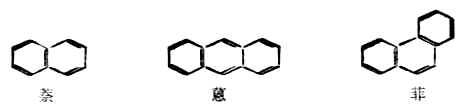
芳香烴是合成芳香族化合物的重要原料,而芳香族化合物又是醫學、染料及國防等工業的重要物質。芳香烴主要來自石油C5-C8餾分的芳構化,即從石油加工中製取。
目錄 |
一、苯的結構
根據元素分析和相對分子質量的測定,證明苯的分子式C6H6。由苯的分子式可見,碳氫比和乙炔相同,都是1:1,它應具有不飽和性,但是事實並非如此。苯極為穩定,不易氧化,難起加成反應,但在催化劑的作用下,易發生取代反應。由此證明,苯的性質與不飽和烴大有區別。苯的這種性質來自苯的特殊結構。
1865年凱庫勒首先提出了苯的環狀結構,即六個碳原子彼此連結成環,每個碳原子上都結合著一個氫原子。為了滿足碳的四價,凱庫勒提出如下的構造式:
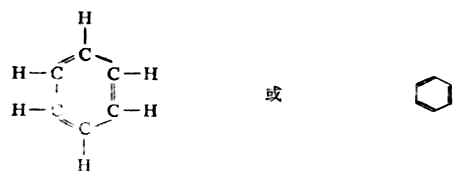
凱庫勒的這種環狀構造式在一定程度上反映了客觀事實,如苯在一定條件下,催化加氫生成環己烷。這說明了苯分子的六個碳原子結合成環狀結構。但凱庫勒式還不能解釋分子中雖含有三個雙鍵,為什麼不出現與烯烴相類似的加成反應。另外,苯的鄰位二元取代物只有一種,而凱庫勒的構造式卻能有兩種。

為了解釋這種情況,凱庫勒認為分子中的單、雙鍵不是固定的,它們可以相互轉變。
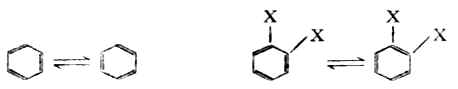
多年來,人們對於苯提出了多種構造式,但還沒有一種能比較完善地表示它的結構。
經過現代物理方法的研究,證明苯分子中的六個碳原子都是sp3雜化的。每個碳原子各以兩個sp2雜化軌道分別與另外兩個碳原子形成C-Cσ鍵。這樣六個碳原子構成了一個正六邊形的環狀結構。每個碳原子上的另一個sp2軌道,其電子云的對稱軸在正六邊形的平面上,這個sp2雜化軌道與氫原子的1s軌道,其電子云的對稱軸在正六邊形的平面上,這個sp2雜化軌道與氫原子的1s軌道形成C-Hσ。因此苯人子中的所有原子都在一個面上,鍵角都是120°[圖12-(a)],每個碳原子還有一個未參與雜化的pz雜化軌道[圖12-(b)],它的對稱軸垂直於此平面,能與相鄰的兩個碳原子上的pz軌道分別從側面平行重疊,形成了一個閉合的共軛體系[圖12-5(c)],在這個體系中,環上有六個碳原子和六個π電子,離域的π電子云完全平均化,體系能量低,比較穩定。π電子云成兩個輪胎狀[圖12-5(d)],均勻分布在苯環平面的上下兩側。苯分子中的碳-碳鍵長也完全平均化,都是0.1393nm。這種具有6π電子閉合共軛體系,使得苯環具有高度的對稱性和特殊的穩定性。由於形成了閉合共軛體系,無單、雙鍵之分,故苯的鄰位二元取代物只能有一種。
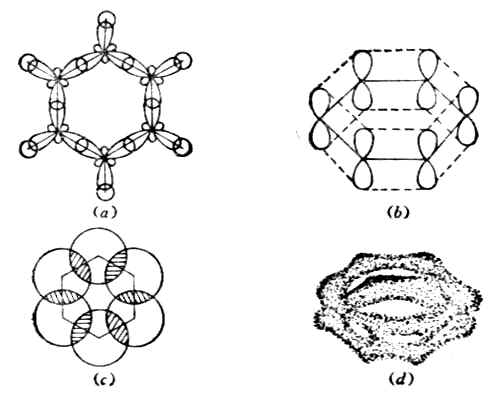
目前國內、外多採用凱庫勒式![]() ,但不要理解為苯分子中存在單鍵和雙鍵,另一種表示方法是用正六邊形碳環中畫一圓圈
,但不要理解為苯分子中存在單鍵和雙鍵,另一種表示方法是用正六邊形碳環中畫一圓圈![]() (代表環狀共軛π
(代表環狀共軛π
鍵)的式子表示。
二、苯的同系物的異構現象和命名
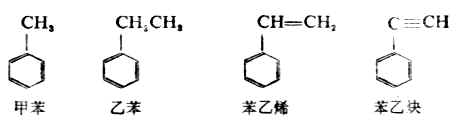
苯的同系物是指苯分子中氫原子被烴基取代的衍生物。當苯環上只有一個取代基時,可以苯環為母體命名,烷基作取代基。若側鏈為不飽和烴基(如烯基或炔基)等,則以不飽和烴為母體命名,苯環(苯基)作為取代基。例如:
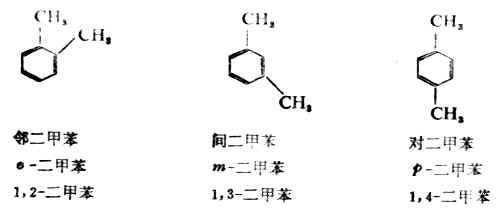
當苯環上有兩個取代基時,則有三種位置異構體。兩個取代基的相對位置,可用鄰(o)、對(p)和間(m)或數字表示。
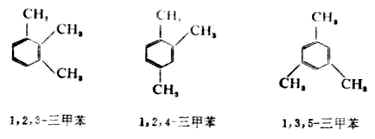
當苯環上有三個或三個以上取代基時,它們的位置用數字表示。
芳香烴分子中的一個氫原子被去掉後,所餘下的原子團稱為芳基,常用Ar表示。例如:

三、苯及其同系物的性質
(一)物理性質
苯和它的常見同系物一般為無色的液體,不溶於水,易溶於有機溶劑。相對密度0.8-0.9。芳香烴一般都有毒性。液體芳香烴常用作有機溶劑。苯及其同系物的物理常數見表12-2。
表12-2 苯的同系物
| 名稱 | 熔點℃ | 沸點℃ | 相對密度(d204) |
| 苯 | 5.5 | 80.1 | 0.8765 |
| 甲苯 | -95 | 110.6 | 0.8669 |
| 鄰二甲苯 | -25.2 | 144.4 | 0.8802 |
| 間二甲苯 | -47.9 | 139.1 | 0.8641 |
| 對二甲苯 | -13.2 | 138.4 | 0.8610 |
| 乙苯 | -93.9 | 136.2 | 0.8667 |
| 連三甲苯 | <-15 | 176.1 | 0.8943 |
| 偏三甲苯 | -57.4 | 169.4 | 0.8758 |
| 均三甲苯 | -52.7 | 164.7 | 0.8651 |
| 正丙苯 | -101.6 | 159.2 | 0.8620 |
| 異丙苯 | -96.9 | 152.4 | 0.8617 |
(二)化學性質
由於苯及同系物分子中都含有苯環,故它們的化學性質與飽和烴具有明顯的不同,具有特殊的「芳香性」。主要表現在取代、加成和氧化反應上,其中以取代反應為重要。
1.取代反應
在一定條件下,苯環上的氫原子易被其它的原子或原子團取代。
(1)鹵代反應:在鐵粉或鹵化鐵的催化下,氯或溴原子可取代苯環上的氫,主要生成氯苯或溴苯。
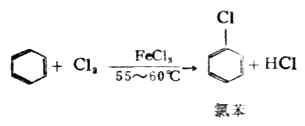
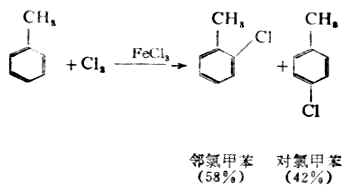
在同樣的催化劑存在時,苯的同系物與鹵素的反應比苯容易。一烷基苯與鹵素反應主要是鹵素取代烷基的鄰位或對位上的氫原子。
如果不用催化劑,而是在日光或加熱的條件下甲苯與氯氣反應,則取代不是發生在苯環上,而是發生在側鏈上,即甲基上的氫逐個地被氧化(自由基取代)。
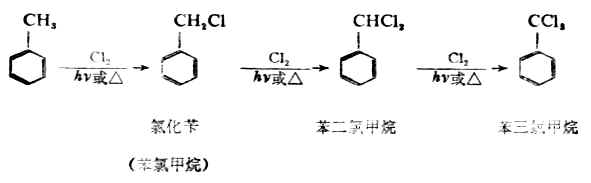
每步反應都有氯化氫身生成。如果控制氯氣的量,可以使反應停止在生成氯化芐的階段。
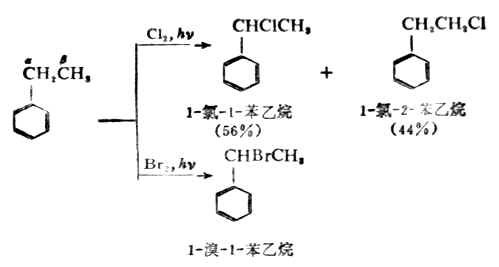
在光照下,乙苯與氯的反應得到一個混合物。一般說來,在進行自由基鹵代時,α-H比β-H容易被取代。乙苯與溴在日光下反應時,α-溴乙苯幾乎是唯一產物,表明了自由基溴代時,溴對不同氫原子取代的選擇性。
(2)硝化反應苯與濃硝酸及濃硫酸的混合物(混熱)共熱後,苯環上的氫原子被硝基(-NO2)取代,生成硝基苯。
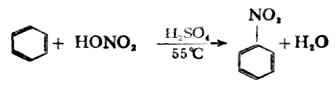
在有機化合物分子中引入硝基的反應叫做硝化反應。
硝基苯不易繼續硝化。如果用發煙硝酸和濃硫酸在95℃時,硝基苯可轉變為間二硝基苯。
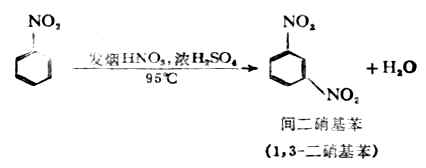
所以當苯環上帶有硝基時,再引入第二個硝基到苯環上就比較困難;或者說,硝基苯進行硝化反應比苯要難。此外,第二個硝基主要是進入苯環上原有硝基的間位。
苯的同系物發生硝化反應時比苯要容易。硝基主要進入烷基的鄰位及對位。
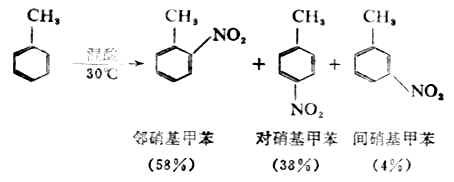
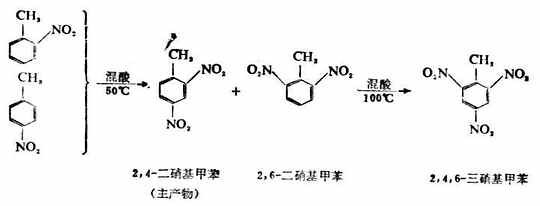
如果反應溫度為50℃時,鄰及對硝基甲苯繼續硝化,主要得2,4-二硝基甲苯,後者在100℃時進一步反應,生成2,4,6-三硝基甲苯(INT),它是一種重要的炸藥。
(3)磺化反應 苯與濃硫酸在75-80℃或發煙硫酸(SO3+濃H2SO4)在40℃時反應。苯環上的氫原子被磺酸基(-SO 3H)取代,生成苯磺酸。
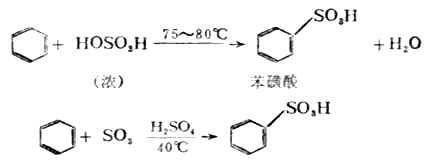
在有機化合物分子中引入磺酸基的反應叫做磺化反應。
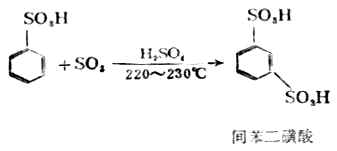
苯磺酸繼續磺化時,需要用發煙硫酸及較高溫度,產生主要為間苯二磺酸。可見,苯環上已有了磺基後,再引入第二個磺基時比苯要難,而且第二個磺基主要進入原來磺基的間位。
苯的同系物的磺化反應比苯容易進行。例如,甲苯與濃硫酸在常溫下即可發發生碘化反應,主要產生是鄰及對苯磺酸。如在100-120℃時反應,則對甲苯酸為主要產生。
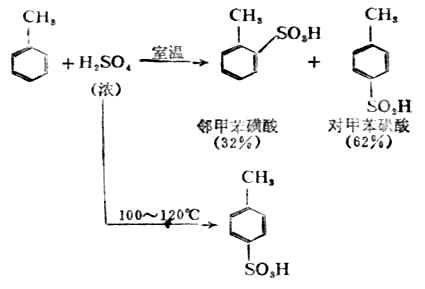
碘酸是有機強酸,易溶於水,其酸性可與無機強酸相比。
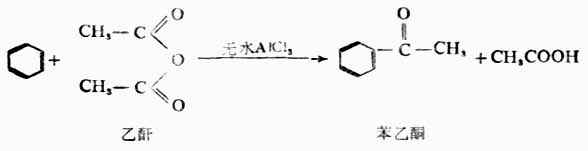
(4)傅-克反應:芳香烴在無水ALCL3作用下,環上的氫原子也能被烷基和醯基所取代。這是一個製備烷基烴和芳香酮的方法,稱為傅瑞德爾-克拉夫慈反應,簡稱傅-克反應。
① 烷基化反應

② 醯化反應:

2.氧化反應
苯環本身很穩定,在一般情況下難以氧化。苯的同系物則能與一些氧化劑(如重鉻酸鉀的酸性溶液、高錳酸鉀溶液)反應。這時,苯環的側鏈被氧化,只要側鏈上有α-H,無論側鏈烷基長短如何,都被氧化為與苯相連的羧基。
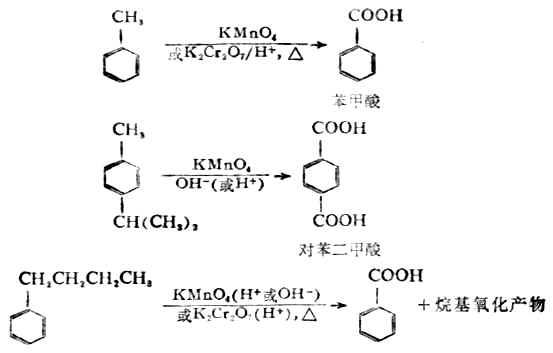
叔丁基苯不含α-H,在上述條件下不被氧化。
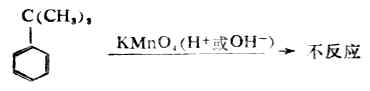
在劇烈的條件下和催化劑存在時,苯環才被破壞。例如:
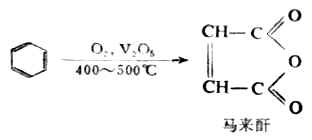
3.加成反應
環苯在一般條件下不容易發生加成反應。當在催化劑、高溫或光的影響下,也可加成。
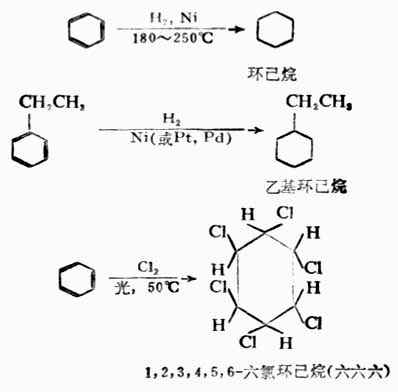
溴與苯可進行類似反應。
苯的同系物與鹵素在日光下,不發生加成反應,而是在側鏈上取代。
四、苯環上親電取代反應的歷程
苯及其同系物在苯環上的取代反應,包括鹵化、硝化、磺化、烷基化及醯化等,是一個帶正電荷的原子或原子團(E+)首先進攻苯環而進行的反應,故是一個親電取代。它的整個過程用下式表示。
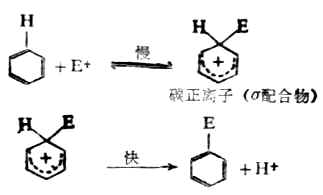
(一)鹵化
苯與鹵素在催化劑(例如FeCL3)存在下的鹵化,是由親電試劑發動進攻的。這個反應的親電試劑與鹵化鐵生成的配合物。
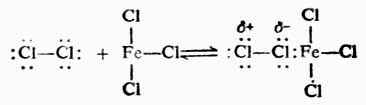
取代反應分兩步進行。
第一步,親電試劑進攻苯環的π電子與CL+生成C-CL鍵被親電試劑進攻的碳原子變為sp3雜化,而破壞了原來的環狀共軛體系。環上其餘的五個sp2雜化的碳原子組成了一個共軛體系,這個體系包括五個碳和四個π電子,它帶一個正電荷,連同環上的一個sp3碳原子構成σ配合物。
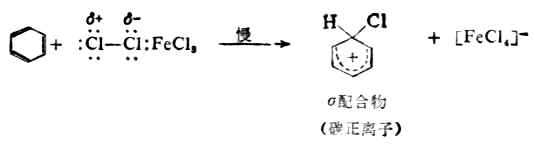
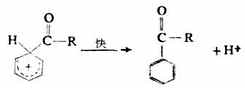
第二步,中間體碳正離子脫去一個質子,生成取代產物。
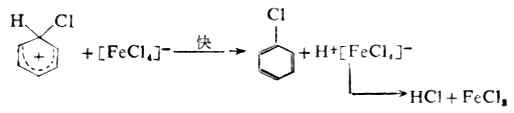
第一步是決定反應速率的一步,它是由親電試劑對底物進攻,與烯烴的親電加成的第一步相似。但在這裡整個反應是取代,所以叫做親電取代。第二步不同於烯烴的是從碳正離子脫去質子,而不是碳正離子與陰離子的結合,這是由於苯環比較穩定的緣故。
催化劑氯化鐵促進氯分子極化,並與帶負電荷的部分配合,使氯的親電性加強。如果苯環上有強的活化基團,如羧基,鹵化反應可不需加鹵化鐵。
(二)硝化
苯及同系物硝化反應的親電試劑是硝金翁離子(![]()
)。在混酸中,它
是由濃硝酸與濃硫酸作用生成的。
![]()
硝金翁離子O=→O是很強的親電試劑。
在有些情況下,硝化反應不用混酸而用硝酸。這時的硝金翁離子是通過下式生成的:
![]()
(三)磺化
苯及同系物磺化時,進攻試劑是親電的三氧化硫。
![]()
三氧化硫是電中性的分子,但它發生極化:
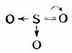
磺化反應可能分步進行。
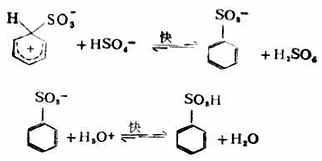
第一步,親電試劑SO3的進攻,與苯生成σ配合物。這個σ配合物作為一個整體不帶電荷,但環中的五個sp2碳及-SO-3兩部分分別帶一個正電荷信一個負電荷。
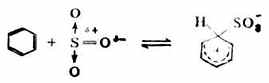
第二步和第三步轉變為苯磺酸。
(四)傅-克反應
傅-克反應歷程和硝化反應歷程相似。
1.烷基化
親電試劑是碳正離子R+,它是由以下過程生成的。
R-X+AlCl3→R++[AlCl3X]-
烷基化由以下兩步進行:
第一步:
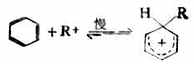
第二步:
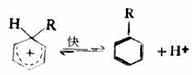
2.醯基化:
親電試劑是正離子![]()
,它是由以下過程生成的。
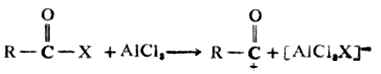
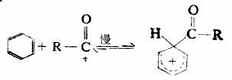
醯基化由以下兩步進行:
第一步:
第二步:
五、苯環上親電取代的定位規律
實驗證明當苯環上已經有一個取代基存在,再引入第二個取代基時,則第二個取代基進入的位置和難易程度主要決定於原有取代基的性質,而與進入的取代基關係較少。這應是苯環親電取代的定位規律。因此,把苯環上已有的取代基叫做定位取代基。根據許多實驗事實,可以把定位取代基分為兩類。
(一)、鄰、對位定取代基
當苯環上已帶有這類定位取代基時,再引入的其它基團主要進入它的鄰位或對位,而且第二個取代基的進入一般比沒有這個取代基(即苯)時容易,或者說這取代基使苯環活化。下面是常見的鄰、對位定位取代基。它們的定位取代效應按下列次序而漸減。
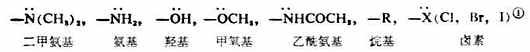
這類定位取代基的特徵是,取代基中直接與苯環相連的原子大多數是未共用電子對或不含飽和鍵(但有例外,如-CH=CHCO2是鄰、對位定位取代基)。
(二)間位定位取代基
當苯環上已存在這類定位取代基時,再引入的其它基團主要進入它的間位,而且第二個取代基的進入比苯要難,或者說這個取代基使苯環鈍化。下面是常見的間位定位取代基,它們的定位效應按下列次序而漸減。
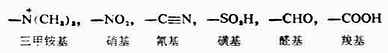
這類定位取代基的特徵是,取代基中直接與苯環相連的原子一般都含有不飽和鍵或帶有正電荷。
苯環的取代規律在實際應用上很有意義,因為掌握了這個規律,就可以預知取代反應中的主要產物。
取代定位規律並不是絕對的。實際上在生成鄰位及對位產物的同時,也有少量間產物生成;在生成間位產物的同時,也有少量的鄰位和對位產物生成。例如當甲苯在0℃下磺化時,除生成52.5%的對甲基磺酸和42.7%的鄰甲基苯磺酸外,還生成3.8%的間甲基苯磺酸。
(三)二取代苯的取代定位規律
如果苯環上已經有了兩個取代基,當引入第三個取代基時,影響第三個取代基進入的位置的因素較多。定性地說,兩個取代基對反應活性的影響有加和性。人們從實際工作中得出了以下的經驗規律:
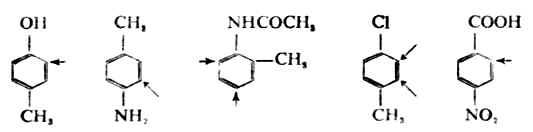
1.苯環上已有兩個鄰對位定位取代基或兩個間位定位取代基,當這兩上定位取代基的定位方向有矛盾時,第三個取代基進入的位置,主要由定位作用較強的一個來決定。如果兩上定位取代基的作用強度相近,將得到數量相近的異構體。例如,下列化合物進行親電取代反應時,第三個取代基主要進入的位置用「→」表示。
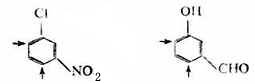
2.苯環上已有一個鄰對位定位取代基和一個間位定位取代基,且二者的定位方向相反,這時主要由鄰對位定位取代基來決定第三個取代基進入的位置。例如:
3.兩個定位取代基在苯環的1位和3位時,由於空間位阻的關係,第三個取代基在2位發生取代反應的比例較小。例如:
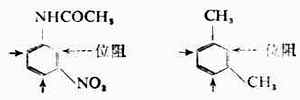
六、苯及其主要同系物
(一)苯
苯為無色液體,具有特殊氣味,易燃燒。熔點5.5℃,沸點80℃。不溶於水,易溶於有機溶劑。苯有毒性,可致癌。
苯是重要的化工原料,也是優良的有機溶劑。
(二)甲苯
甲苯為無色液體,易燃燒,揮發性強。甲苯主要用以合成硝基甲苯、TNT、苯甲酸、苯甲醛等。甲苯也用作溶劑。
(三)二甲苯
二甲苯有三種異構體(鄰、間、對位)。三種異構體的混合物為無色液體,易燃。不溶於水,易溶於有機溶劑。二甲苯在醫學上製作組織切片標本時,用於脫醇、脫脂、二甲苯也是一種重要的有機合成原料。
| 關於「醫用化學/芳香烴」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |