醫用化學/脂環烴
| 醫學電子書 >> 《醫用化學》 >> 環烴 >> 脂環烴 |
| 醫用化學 |
|
|
脂環烴是具有鏈烴性質的環烴。脂環烴及其衍生物廣泛存在於自然界中,例如有些地區所產的石油中含多量的環烷烴;一些植物中含有的揮髮油(精油),其成分大多是環烯烴及其含氧衍生物。揮髮油是中草藥中重要的有效成分,有的可作香料。在自然界廣泛存在甾族化合物都是脂環烴的衍生物,在人體中起重要作用。
一、脂環烴的分類和命名
脂環烴分為飽和環烴和不飽和脂環烴。飽和脂環烴稱為環烷烴;不飽脂環烴又分為環烯烴和環炔烴。環烷烴和環烯烴較多見,環炔烴則較少見。依環數多少又可把脂環烴分為單環脂烴和多環脂烴。
環烷烴中只有一個碳環的稱為單環烷烴,它的通式為CnH2n,與單烯烴互為同分異構體。單環烷烴可分為大環(環上的碳原子數≥12)、中環(8~11個碳)、普通環(5~7個碳)和小環(3~4個碳)。到目前為止,已知的大環有三十碳環,最常見的是五碳環(環戊烷)和六碳環(環己烷)。
單環烷烴的命名是根據組成環的碳原子數為環某烷。例如:
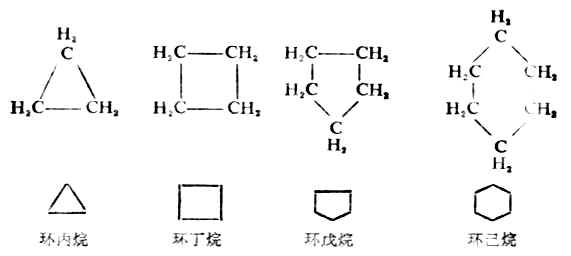
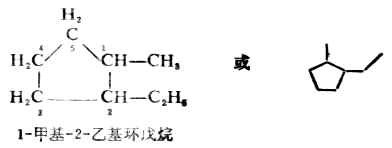
環上如有取代基時,取代基的位次儘可能採用最小數標出;若有不同取代基時,則以含碳最少的取代基作為1位。例如:
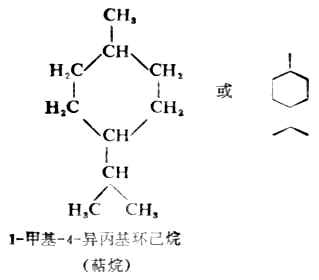
單環烯烴的命名,稱為環某烯。標明雙鍵位置以最小的數為原則。若有取代基時,取代基的位置數則以雙鍵為準依次排列。例如:
脂環烴中具有幾個環(常見的為雙環)且共用一個、兩個或兩個以上碳原子的叫做多環脂烴。
二、環烷烴的結構
環烷烴中的碳原子也是sp3雜化的,它們的雜化軌道之間的夾角應為109°28′。但環丙烷的三個碳原子在一個面上,C-C間的sp3雜化軌道沒有在兩原子核連線的方向上重疊,也就是沒有達到最大程度的重疊,如圖12-1。所以分子內存在一種達到最大重疊的傾向,這種傾向就叫做「張力」。因此內能較高,環不穩定。環丁烷的情況與環丙烷相似,分子中也存在著張力,但比環丙烷要穩定得多。
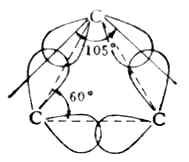
圖13-1 環丙烷中sp3雜化軌道重疊示意圖
五個碳以上的環烷烴環上的碳的碳原子並不都在同一平面上,C-C鍵角為109°28′左右。例如環戊烷的組成環的五個碳中只有四個是處在同一個平面上,另一個碳在平面外。這樣的結構在不斷地翻動著,處於平面外的碳沿著環迅速地變換。因而環戊烷是一個有一隻角向上的近平面結構。

環戊烷
環己烷有四個碳原子在一個面上,其它兩個碳一個在此平面的上方,另一個在這個平面的下方(椅型);或者兩個都在此平面的上方(船型)。
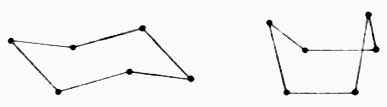
椅式 船式
環己烷的六個成環碳原子不共平面,C-C-C鍵角保持正常鍵角109°28′。通過鍵的扭動可 以得到椅型和船型兩種不同的排列方式。
從不己烷的椅型構象和船型構象可以清楚地看出,椅型環己烷中所有相鄰兩個碳原子的碳氫鍵都處於正丁烷的鄰位交叉式,非鍵合的C-1和C-3上的氫原子相距0.25nm,屬於正常的原子間距。而船型環己烷的構象中,有兩對碳原子(C-2與C-3;C-5與C-6)的鍵相互處於重疊式;同時又由於船頭及船尾(C-1與C-4)的兩個碳氫鍵是向內伸展的,相距較近,約0.183nm,比正常的非鍵合原子的間距小,故斥力較大,能量較高。實驗證明,船型比椅型的能量高29.7kJ.mol-1左右。在常溫下,環己烷是兩種構象混合物,其中主要以椅型環己烷相聚在,船型只約佔0.1%.
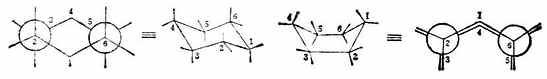
(紐曼投影式) (透視式) (透視式) (紐曼投影式)
椅型 (船型)
在椅型環己烷中,六個碳原子在空間分布於兩個平面上,C-1、C-3、C-5在同一平面上,C-2、C-4、C-6在另一平面上。這樣,環己烷中的十二個碳氫鍵可以分為兩種類型,其中六個是垂直於平面而與對稱軸平行的,叫直立鍵或a鍵,三個向上,三個向下,交替排列。另六個大致與環平面平行,實際與對稱軸成±19.5°角,叫平伏鍵或e鍵(如圖12-3).
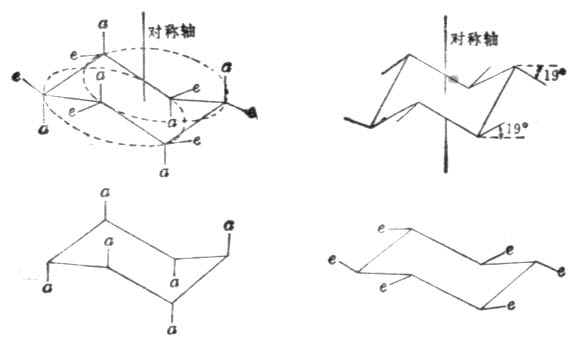
在室溫下,環己烷的一種椅型構象,可以通過C-C鍵的扭動很快地轉變為另一種椅型構象.這時原來的a鍵就變成了e鍵,原來的e鍵變成了a,但對應平面上下關係不變(圖12-4)。

圖12-4 兩種椅型構象的轉變
對環己烷來說,這兩種構象可以相互轉變,但環上有取代基時情況不同。
一元取代的環己烷,其取代基可以a鍵,也可以連在e鍵上,形成兩種不同的構象。一般以e鍵取代的構象能量較低,比較穩定。這是因為e鍵上的取代基與環上同側的兩個a鍵上的氫原子距離較遠,斥力較小,較為穩定。例如,甲基環烷在室溫時,當取代基在a鍵上時,則與環上同側的兩個a鍵上氫的距離較近,斥力較大,故不穩定。甲基環烷在室溫時,當取代基在a鍵 上時,則與環上同側的兩個a鍵上的氫的距離較近,斥力較大,故不穩定。甲基以e鍵連結的分子約佔95%,而以a鍵連結的分子僅佔5%,且存在如下的動態平衡:
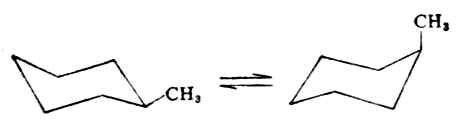
95%5%
當取代基越大時,這種以e鍵取代的構為主的趨勢越大。
二元取代的環己烷可以有1-2-,1-3-和1.4-三種位置異構體,在每一種構體中,又有順式與反式異構體。以1,2-二甲基環己烷為例,順式異構體中兩個甲基位於環平面的同側,其相應的構象式為:
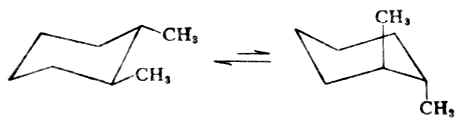
這兩個構象式實際上是相同的,都是一個甲基連於e鍵,另一個甲基連於a鍵,能量相同,穩定性相同。
反式異構體中,兩個甲基位於環的異側,兩個甲基可以都連在兩個e鍵上(ee型),或都連於兩個a鍵上(aa型)。顯然ee型比較穩定。所以,反式1,2-二甲基環己烷主要以ee型的構象存在。
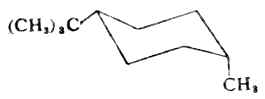
當兩個取代基不相同時,如順-1-甲基-4-叔丁基在e鍵,甲基在a鍵的構象為優勢構象。

所以環己烷和取代環己烷的構象穩定性有如下規律:
①椅型構象比船型構象穩定。
②環己烷的一元取代物中,以e鍵取代物穩定;多元取代物中,以e-取代多的構象較穩定。
③環上有不同的取代基時,大的取代基結合在e鍵上的構象最穩定。
三、脂環烴的性質
(一)物理物質
脂環烴的物理性質與鏈烴相似。環丙烷和環丁烷在常溫下是氣體,環戊烷是液體,高級環烷烴是固體,如環三十烷的熔點為56℃。環烷烴的熔點、沸點和相對密度都比含同數碳原子的烷烴為高(表12-1)。
表12-1 一些環烷烴及烷烴的物理常數比較
| 化合物 | 熔點/℃ | 沸點/℃ | 相對密度(d204) |
| 環丙烷 | -127.6 | -32.9 | 0.720(-79℃) |
| 丙烷 | -187.69 | -42.07 | 0.5005(7℃) |
| 環丁烷 | -90 | 12.5 | 0.703(0℃) |
| 丁烷 | -138.45 | -0.5 | 0.5788 |
| 環戊烷 | -93.9 | 49.3 | 0.7454 |
| 戊烷 | -129.72 | 36.07 | 0.6262 |
| 環己烷 | 6.6 | 80.7 | 0.7786 |
| 己烷 | -95 | 68.95 | 0.6603 |
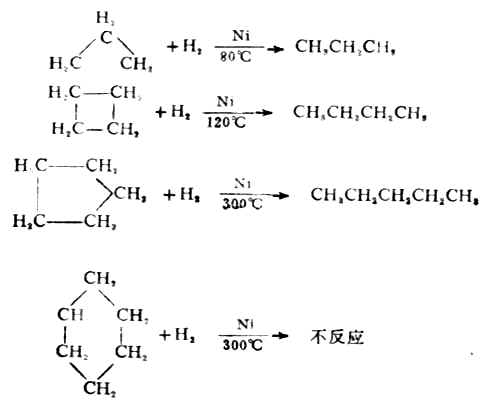
1.加氫
環烷烴可進行催化氫化反應,氫化時環被打開,兩端碳原子與氫原子結合而生成鏈狀的烷烴。在氫化過程中,由於環烷烴環的大小不同,反應的難易程度也不一樣。
(二)化學性質
從化學鍵的角度來分析,環烷烴與烷烴相似;環烯烴和環炔烴分別與烯烴和炔烴相似。但是,由於脂環烴具有環狀構造,小環烴出現的一些特殊的化學性質。主要表現在環的穩定性上,小環較不穩定,大環則較穩定。
1.加氫
環烷烴可進行催化氫化反應,氫化時環被打開,兩端碳原子與氫原子結合而生成鏈狀的烷烴。在氫化過程中,由於環烷烴環的大小不同,反應的難易程度也不一樣。
2.加鹵素
環丙烷在常溫下,環丁烷在加熱時分別與氯或溴發生加成反應,開環得1,3-或1,4-二鹵代烷。
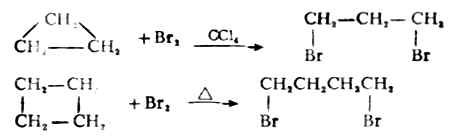
環戊烷及更高級的環烷烴與鹵素不發生加成反應,而是進行自由基取代。例如:
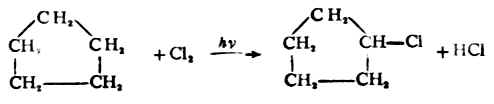
3.加氫鹵酸
環丙烷在常溫時與氫鹵酸發生加成反應得鹵丙烷。環上有烷基取代的環丙烷衍生物與氫鹵酸的加成符合馬氏規則。碳環打開,氫原子加在連氫較多的碳原子上,而鹵原子則加在連氫較少的碳上。
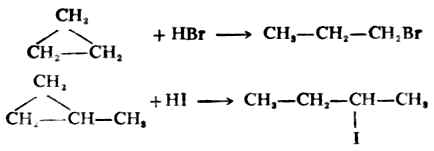
常溫時,環丁烷、環戊烷及更高級的環烷烴與氫鹵酸不起反應。
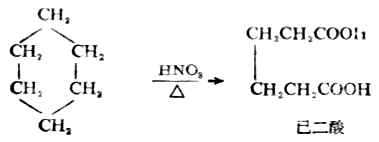
另外,若以強氧化劑在加熱條件下與環烷烴作用時,則環斷裂,生成二元羧酸。例如:
| 關於「醫用化學/脂環烴」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |