醫用化學/雜環化合物
| 醫學電子書 >> 《醫用化學》 >> 雜環化合物和生物鹼 >> 雜環化合物 |
| 醫用化學 |
|
|
在環狀有機化合物中,組成環的原子除碳原子外,還有其它非碳原子時,這類化合物稱為雜環化合物。這些非碳原子叫做雜原子,常見的雜原子有氮、氧、硫。
根據以上定義,雜環化合物似乎應包括內酯、交酯和環狀酸酐等,但由於它們與相應的開鏈化合物性質相似,又容易開環變成開鏈化合物,所以不包括在雜環化合物之內。本章主要討論那些環系比較穩定,並且有不同程度芳香性的雜環化合物。所謂芳雜環化合物是保留芳香結構即6π電子閉合共軛體系的雜環。這類化合物比較穩定,不易開環,而且它們的結構和反應活性與苯有相似之處,即有不同程度的芳香性,所以稱為芳雜環化合物。
一、雜環化合物的分類和命名
雜環化合物可按雜環的骨架分為單雜環和稠雜環。單雜環又按環的大小分為五元雜環和六元雜環;稠雜環按其稠合環形式分為苯稠雜環和稠雜環。如表19-1所示。
雜環化合物的命名主要採用外文譯音法,把雜環化合物的英文名稱的漢字譯音加「口」字旁表示。例如:

呋喃(furan) 吡啶(pyridine)
外文譯音法是根據國際通用名稱譯音的,使用方便,缺點是名稱和結構之間沒有任何聯繫。
雜環化合物的環上原子編號,除個別稠雜環如異喹啉外,一般從雜原子開始。
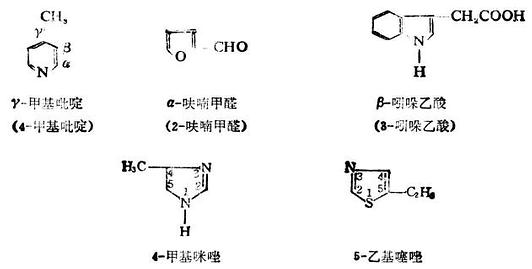
環上只有一個雜原子時,雜原子的編號為1。有時也以希臘字母α、β及γ編號,鄰近雜原子的碳原子為α位,其次為β位,再次為γ位。
當雜環上連有-R,-X,-OH,-NH2等取代基時,以雜環為母體,標明取代基位次;如果連有-CHO,-COOH,-SO3H等時,則把雜環作為取代基。環上有兩個或兩個以上相同雜原子時,應從連接有氫或取代基的雜原子開始編號,並使這些雜原子所在位次的數字之和為最小。環上有不同雜原子時,則按氧、硫、氮為序編號。例如:
表19-1 常用雜環化合物的構造式和名稱
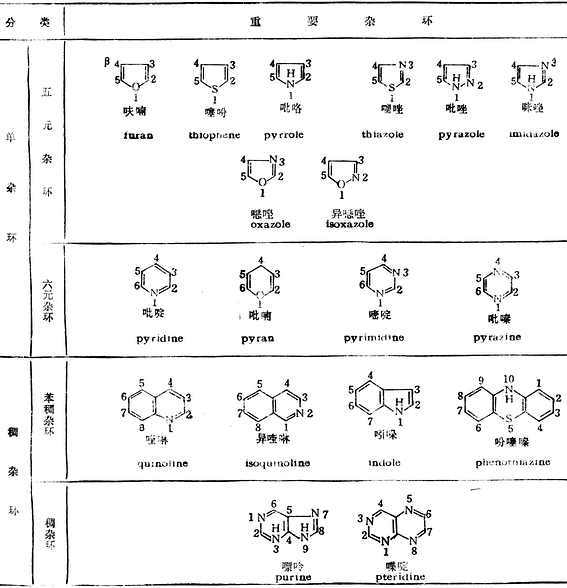
另有特殊編號的,如嘌呤等(見表19-1)。
二、雜環化合物的結構
五元雜環化合物呋喃、噻吩、吡咯的結構和苯相類似。構成環的四個碳原子和雜原子(N,S,O)均為sp2雜化狀態,它們以σ鍵相連形成一個環面。每個碳原子餘下的一個p軌道有一個電子,雜原子(N,S,O)的p軌道上有一對未共享電子對。這五個p軌道都垂直於五元環的平面,相互平行重疊,構成一個閉合共軛體系,即組成雜環的原子都在同一平面內,而p電子云則分布在環平面的上下方,如圖19-1所示。
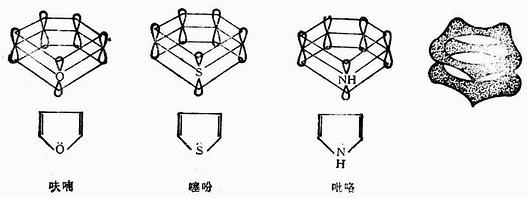
圖19-1 呋喃、噻吩和苯的分子結構
從上圖可看出呋喃、噻吩、吡咯的結構和苯結構相似,都是6電子閉合共軛體系,因此,它們都具有一定的芳香性,即不易氧化,不易進行加成反應,而易起親電取代反應。由於共軛體系中的6個π電子分散在5個原子上,使整個環的π電子云密度較苯大,比苯容易發生親電取代。同時,α位上的電子云密度較大,因而親電取代反應一般發生在此位置上,如果α位已有取代基,則發生在β位。
與苯比較,環的芳香穩定性不如苯環,電子云密度分布也不完全平均化。由於雜原子電負性大小不同(O>N>S),電子云離域有差異,所以它們的芳香性強弱有差異,環的穩定性也不同。
含有兩個雜原子(其中至少有一個氮原子)的五元雜環稱為唑。常見的有咪唑、吡唑和噻唑。

咪唑、吡唑、噻唑的電子結構與上述幾個環系類似,同樣具有閉合的6個電子共軛體系,所以這些雜環也都具有一定的芳香性。例如,咪唑可以看作是吡咯環上氮原子的間位「-CH=」被「-N=」取代的衍生物。這個「-N=」的氮原子上未共用電子對參與環的共軛體系,可與質子結合併保持閉合的6電子共軛體系,所以咪唑也有芳香性,並且顯弱鹼性(ψKb=6.9)。
六元雜環的結構可以吡啶為例來說明。吡啶在結構上可看作是苯環中的-CH=被-NH=取代而成。5個碳原子和一個氮原子都是sp2雜化狀態,處於同一平面上,相互以σ鍵連接成環狀結構。每一個原子各有一個電子在p軌道上,p軌道與環平面垂直,彼此「肩並肩」重疊形成一個包括6個原子在內的,與苯相似的閉合共軛體系。氮原子上的一對未共用電子對,佔據在sp2雜化軌道上,它與環平面共平面,因而不參與環的共軛體系,不是6電子大π鍵體系的組成部分,而是以未共用電子對形式存在,如圖19-2所示。
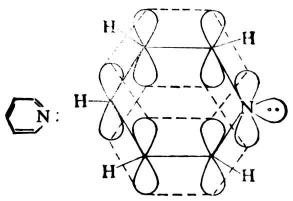
圖19-2吡啶分子結構
吡啶分子中的C-C鍵長(0.139-0.140nm)與苯分子中的C-C鍵長(0.140nm)相似;C-N鍵長(0.134nm)較一般的C-N鍵長(0.147nm)短,但比一般的C=N雙鍵(0.128nm)長。這說明吡啶的鍵長平均化程度較高,但並不像苯一樣是完全平均化的。所以吡啶具有芳香性。然而又由於吡啶環中氮原子的電負性大於碳原子,所以環上的最子云密度因向氮原子轉移而降低,親電取代比苯難。此環上氮原子具有與間位定位基-NO2相仿的電子效應,鈍化作用使親電性取代較苯困難,取代基進入間位,且收率偏低。
吡啶環上的氮原子有一對未共用電子對參與6電子共軛體系,可與質子結合,故其鹼性(PKb=8.8)較吡咯(pKb=13.6)強,也比苯胺(pKb=9.3)強,能與強酸作用生成較穩定的鹽。但比氨(pKb=4.75)弱,也比脂肪叔胺(三甲胺的pKb=4.22)弱。原因在於吡啶環上未參與共軛體系的這一對未共用電子對處於sp2雜化軌道上,其s成分較sp3雜化軌道多,受原子核束縛強,因而較難與H+結合。
吡啶與水能以任意比例混溶,同時又能溶解大多數極性及非極性有機化合物,它是一個良好的溶劑。吡啶具有高水溶性的原因,除分子極性外,是由於其氮原子上一對未參與環共軛體系的未共用電子對與水分子易形成氫鍵。而吡啶、呋喃和噻吩雜原子的未共用電子對是6電子閉合共軛體系的組成部分,失去形成氫鍵的條件,因此難溶於水。
三、重要的雜環化合物及其衍生物
(一)吡咯、咪唑及其衍生物
吡咯存在於煤焦油和骨焦油中,為無色液體,沸點131℃。吡喀的蒸氣可使浸有鹽酸的松木片產生紅色,稱為吡咯的松木片反應。
吡咯的衍生物廣泛分布於自然界,葉綠素、血紅素、維生素B12及許多生物鹼中都含有吡咯環。
四個吡咯環的α碳原子通過四個次甲基(-CH=)交替連接構成的大環叫卟吩環,舊稱環。卟吩的成環原子都在同一平面上,是一個複雜的共軛體系。卟吩本身在自然界中不存在,它的取代物稱為卟啉類化合物,卻廣泛存在。卟吩能以共價鍵和配位鍵與不同的金屬原子結合,如血紅素的分子結構中結合的是亞鐵原子。
血紅素與蛋白質結合成為血紅蛋白,存在於哺乳動物的紅細胞中,是運輸氧氣的物質。
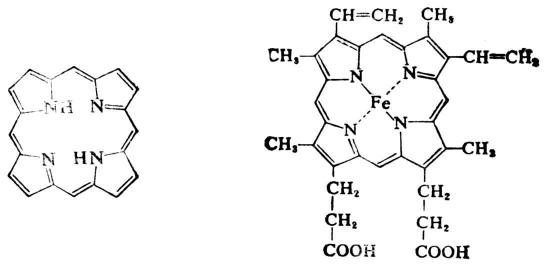
卟吩 血紅素
咪唑的衍生物廣泛存在於自然界,如蛋白質組成成分的組氨酸。組氨酸經酶的作用或體內分解,可脫羧變成組胺。
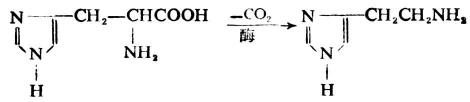
組氨酸組胺
(二)吡啶的重要衍生物
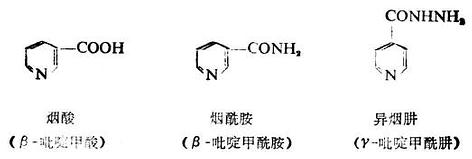
煙酸和煙醯胺兩者組成維生素PP。它們是B族維生素之一,體內缺乏時能引起糙皮病。煙酸還具有擴張血管及降低血膽固醇的作用。
異煙肼又叫雷米封(Rimifon),為無色晶體或粉末,易溶於水,微溶於乙醇而不溶於乙醚。異煙肼具有較強的抗結核作用,是常用治療結核病的口服藥。
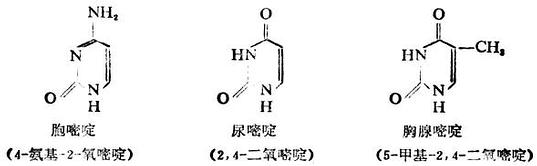
(三)嘧啶及其衍生物
嘧啶是含有兩個氮原子的六元雜環化合物。它是無色固體,熔點22℃,易溶於水,具有弱鹼性。
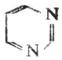
嘧啶
嘧啶可以單獨存在,也可與其它環系稠合而存在於維生素、生物鹼及蛋白質中。許多合成藥物如巴比妥類藥物、磺胺嘧啶等,都含有嘧啶環。
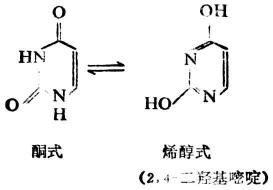
上述嘧啶衍生物有酮式和烯醇式的互變異構現象。如尿嘧啶的互變異構:
(四)嘌呤及其衍生物
嘌呤是咪唑環和嘧啶環稠合而成的稠雜環。嘌呤環共有四個氮原子,環的編號比較特殊,它有兩種互變異構體,常用標氫法區別。
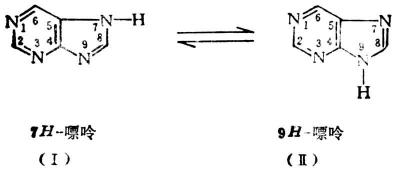
結晶態嘌呤為(Ⅰ)式,在水溶液中(Ⅰ)式與(Ⅱ)式則以等比例共存。藥物分子中一般多為7H-嘌呤(Ⅰ式)衍生物,生物體中則9H-嘌呤(Ⅱ式)更為常見。
嘌呤為無色晶體。熔點216-217℃,易溶於水,能與強酸或強鹼成鹽。
嘌呤本身在自然界並不存在,但它的衍生物分布廣,而且重要,如腺嘌呤、鳥嘌呤等都是核酸的組成成分。

腺嘌呤(A) 鳥嘌呤(G)
(6-氨基嘌呤) (2-氨基-6-羥基嘌呤)
次黃嘌呤、黃嘌呤和尿酸是腺嘌呤和鳥嘌呤在體內的代謝產物,存在於哺乳動物的尿和血中。
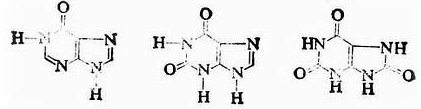
次黃嘌呤黃嘌呤尿酸
(6-氧嘌呤) (2,6-二氧嘌呤)(2,6,8-三氧嘌呤)
尿酸為無色晶體,極難溶於水,有弱酸性。健康的人每天尿酸的排泄量約為0.5-1g。如代謝紊亂而致尿酸含量過高時,可能沉積形成尿結石。當血中的尿酸含量過高時,可能沉積在關節等處,形成痛風石。
上述嘌呤衍生物均有酮式和烯醇式的互變異構現象。如尿酸和黃嘌呤。
尿酸:

酮式烯醇式
黃嘌呤:
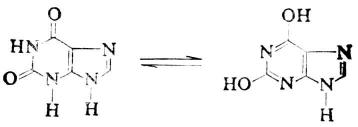
酮式 烯醇式
| 關於「醫用化學/雜環化合物」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |