臨床生物化學/分析方法的分類
| 醫學電子書 >> 《臨床生物化學》 >> 臨床生物化學分析儀的性能與應用 >> 臨床生化自動分析的方法 >> 分析方法的分類 |
| 臨床生物化學 |
|
|
臨床生化常用方法根據其測定的原理可作如圖19-5法分類。一類方法是物理方法,測定是物質固有的物理特性。另一類是物理化學方法,也就是將所測定物質進行一些化學轉化後再進行測定。動態法是在所測定的物質濃度在不斷變化中,由感測器獲得相應的改變的信號進行計算的方法。平衡法是由感測器得到相對不變的信號進行計算的方法。現在越來越多被臨床生化應用的酶試劑方法,無論是用自動分析儀記錄或分光亮度計或普通比色計都包括在動態法的範圍內。
(一)平衡法(終點法)
這類方法的特點是被測物質(酶反應的底物)在酶反應過程中應完全被轉化或消耗掉,即達到反應的終點。通常這類方法操作簡單,一般不需要作標準管,通過一些已知的理化常數,例如克分子吸光係數等不難將結果計算出來。其缺點是反應時間較長,特別不適合於離心式自動分析儀。還有少數酶反應,底物並未完全消耗掉,只是達到一個動態平衡,此時,往往需要同時作標準管。
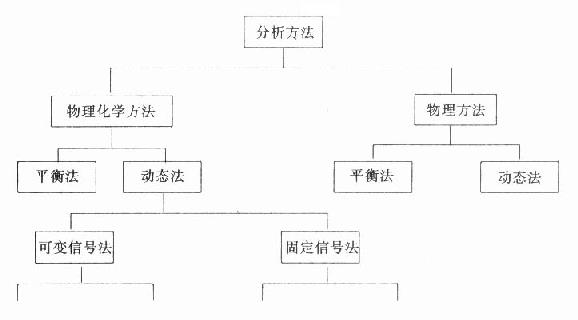
圖19-5 臨床生化方法的分類
⒈一步法 試劑酶的底物(S)就是所測的物質,在試劑酶作用於S後完全轉化為產物(P),由於S和P具有完全不同的理化性質,從而可根據對S或P的濃度變化進行連續監測。使用最多的還是光度法,尤其是在340nm處測定NAD(P)H的生成或消耗量。在實際應用上最多的仍是和NAD(P)H有關的脫氫反應。如用乙醇脫氫酶測乙醇的含量或用乳酸脫氫酶測丙酮酸等。
⒉酶偶聯反應和測定酶活性方法一樣,有時單用一個酶(輔助酶,Ea)不行,因為S和P之間往往無明顯差異,不能直接測定,此時可以加入另外的酶(指示酶,Ei),將反應偶聯起來,通過測定指示酶反應間接推算出所測物質,即第一個酶作用底物的濃度。
反應通式如下:

若Ei是一個脫氫酶,在反應過程中同時伴有NAD(P)H和NAD(P)間的轉化,故不難在340nm處進行連續監測。另一常用的酶是過氧化物酶,可以通過新生態氧和一些色素原作用顯色而進行測定。例如用已糖激酶(HK)法和葡萄糖氧化酶(GOD)法來測定葡萄糖等。
另外,還有一類少用的偶聯酶反應,指示酶反應在輔助酶反應之前,而不是在後。
![]()
式中S1是欲測物質,往往另一底物S2不穩定,通過先行的指示酶產生S2,如乙醯CoA的測定。

從理論上說酶催化反應都是可逆的反應,除水解酶外,大多數酶往往都不易將底物完全轉換或消耗掉。常可通過增加不需測定的另一底物濃度,改變pH,使用捕獲劑(trap-ping agent)等改變平衡點,使反應偏向一側,達到或接近反應完全。
(二)動態法
動態法在自動分析儀中的應用十分廣泛,但是動態法的分類一直比較混亂。一般可分為可變信號法和固定信號法兩類。
⒈可變信號法
⑴直接法即根據所得到的吸光度變化直接計算結果:由於對所收集數據多少有很大意義,所以又區分為一點法、二點法、多點法。一點法是在一個預先設置時間測定各個標本吸光度。二點法則是在一點法基礎上多測一點,即在酶反應仍未進行時的吸光度,和一點法相比可以通過空白測定扣除這部分誤差,但是仍無法了解反應過程,避免不了延緩期或非線性反應所引起的誤差。多點法如使用確當,對標本空白和反應過程都有詳細了解,可用以下兩法:
一法是求出不同測定點間吸光度的差異即所謂delta法。各點吸光度差異可用б=△A=An-An-1計算出。根據這些數據可以觀察反應是否符合線性,並計算出被測物質濃度。偏離線性的數據在計算結果時應摒棄。很多早期自動生化儀都使用此法。另一法則是使用回歸法,根據一定公式如線性公式y=a+bx對獲得的多個數據進行計算,求出斜率b和截距a。這類方法也可用於濃度計算。和delta方法相比,不僅可適用於線性反應,也可適用於其它非線性反應。
⑵導數法在此法中使用電子線路計算出反應瞬間的一階和二階導數:bekman system TR就使用了這樣方法,它可以同時計算出一階和二階導數,用二階導數來觀察哪一段反應為線性反應,並用線性反應段上的一階導數計算出物質濃度。此法單用導數方法並不記錄吸光度變化(△A),所以此法所提供的信息往往少於回歸法,例如無法觀察到反應中底物的消耗情況。
⑶積分法此法原理是運算放大器對反應曲線二個節段的吸光度進行積分。並計算出部分面積之差。Vitatron分析儀用此差值來考慮線性段,但仍用△A法計算結果。
⒉固定信號法測定原理是隨著反應進行,通過不斷添加試劑使吸光度變化在很窄範圍內,此時所測的是加試劑的量,並依此來計算物質濃度。最典型例子是以對硝基酚作為指示劑的乙醯膽鹼酯酶方法,在反應過程中不斷加入鹼以中和酶水解產物乙酸以維持pH不變,然後根據所加鹼量計算酶含量。這一類方法由於操作費時麻煩,目前應用很少,但不應忘記這類方法能維持反應條件如pH的恆定性,其它如在NADH參與的反應中不斷加入NADH有助於避免底物的消耗,在一些特殊情況下可能還是有用的。
由此可見,假如從方便簡單不需複雜儀器而言,則一點和二點法應為首選。而回歸法、積分和導數法不易進行。如從可靠性來進行比較,則多點回歸法應居榜首,一點和二點法最不準確。
回歸法的缺點是此法可以不考慮收集的數據是否可靠,不管各數據是否偏離曲線或明顯不呈線性,也可求得一個線性方程式。所以,一個好的回歸方程式還應給出標準差和有關參數,這樣即可用來評價用回歸法所得結果的可靠性。根據Pardue意見,使用較多數據且設計良好的回歸方法是首選的。
(三)固定時間法(二點法)
固定時間法在自動分析儀中的應用,有助於我們解決反應的特異性問題,最明顯的例子就是苦味酸法測肌酐和溴甲酚綠法測白蛋白。人們早就知道很多物質如維生素C、乙醯醋酸、葡萄糖、果糖以及某些藥物也能和苦味酸呈色。近年來發現這些干擾物質呈色較慢,提出用自動生化儀只測定開始一分鐘的反應,明顯提高了苦味酸法測肌酐的特異性。用溴甲酚綠測白蛋白法,此法由於簡單易行,在70年代取代了經典的鹽析法,但隨即發現一部分球蛋白如α球蛋白也能和溴甲酚綠結合,但這類反應比較遲,所以目前更多地使用自動分析儀測定開始一分鐘的反應來計算白蛋白量。
固定時間法之所以受到愈來愈多注意,更重要因素是酶試劑的應用(詳見有關章節)。
(四)空白對照方法
由於使用了各種高新技術,在自動生化分析儀中人們可以根據實際情況,使用各種空白和對照方法。
⒈固定法空白①試劑;②標本+鹽水;③標本+空白試劑;④標本+滅能試劑;⑤標本+完全試劑(時間不同);
⒉動態法空白①試劑空白;②標本+空白試劑。
從理論上說固定空白法用「標本+完全試劑」是最好的辦法,此法可以扣除各種因素的誤差,如試劑、比色杯等,這也是在自動生化儀應用較多的方法,而用手工法是不易做到的。動態空白僅用於少數試劑不穩定方法,如以固紅B測天門冬氨酸轉氨酶。
| 關於「臨床生物化學/分析方法的分類」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |