細胞粘附分子
| A+醫學百科 >> 細胞粘附分子 |
細胞粘附分子(cell adhesion molecule,CAM)是參與細胞與細胞之間及細胞與細胞外基質之間相互作用的分子。
細胞粘附指細胞間的粘附,是細胞間信息交流的一種形式。而信息交流的可溶遞質稱細胞粘附分子(cell adhesion molecule,CAM)。CAM是一類獨立的分子結構,是通過識別與其粘附的特異性受體而發生相互間的粘附現象。
目錄 |
細胞粘附分子的組成
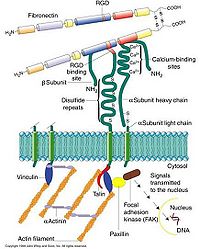
細胞粘附分子都是跨膜糖蛋白,分子結構由三部分組成:①胞外區,肽鏈的N端部分,帶有糖鏈,負責與配體的識別;②跨膜區,多為一次跨膜;③胞質區,肽鏈的C端部分,一般較小,或與質膜下的骨架成分直接相連,或與胞內的化學信號分子相連,以活化信號轉導途徑。
多數細胞粘附分子的作用依賴於二價陽離子,如Ca2+,Mg2+。細胞粘附分子的作用機制有三種模式(圖11-16):兩相鄰細胞表面的同種CAM分子間的相互識別與結合(親同性粘附);兩相鄰細胞表面的不同種CAM分子間的相互識別與結合(親異性粘附);兩相鄰細胞表面的相同CAM分子借細胞外的連接分子相互識別與結合。
細胞粘附分子的分類
可大致分為五類:鈣粘素、選擇素、免疫球蛋白超家族、整合素及透明質酸粘素。
一、鈣粘素
鈣粘素(cadherin)屬親同性CAM,其作用依賴於Ca2+。至今已鑒定出30種以上鈣粘素,分布於不同的組織。
鈣粘素分子結構同源性很高,其胞外部分形成5個結構域,其中4個同源,均含Ca2+結合部位。決定鈣粘素結合特異性的部位在靠N末端的一個結構域中,只要變更其中2個胺基酸殘基即可使結合特異性由E-鈣粘素轉變為P-鈣粘素。鈣粘素分子的胞質部分是最高度保守的區域,參與信號轉導。
鈣粘素通過不同的連接蛋白質與不同的細胞骨架成分相連,如E-鈣粘素通過α-、β-、γ-連鎖蛋白(catenin)以及粘著斑蛋白(vinculin)、錨蛋白、α輔肌動蛋白等與肌動蛋白纖維相連;橋粒中的desmoglein及desmocollin則通過橋粒緻密斑與中間纖維相連。
鈣粘素的作用主要有以下幾個方面:
1.介導細胞連接,在成年脊椎動物,E-鈣粘素是保持上皮細胞相互粘合的主要CAM,是粘合帶的主要構成成分。橋粒中的鈣粘素就是desmoglein及desmocollin。
2.參與細胞分化,鈣粘素對於胚胎細胞的早期分化及成體組織(尤其是上皮及神經組織)的構築有重要作用。在發育過程中通過調控鈣粘素表達的種類與數量可決定胚胎細胞間的相互作用(粘合、分離、遷移、再粘合),從而通過細胞的微環境,影響細胞的分化,參與器官形成過程。
3.抑制細胞遷移,很多種癌組織中細胞表面的E鈣粘素減少或消失,以致癌細胞易從瘤塊脫落,成為侵襲與轉移的前提。因而有人將E鈣粘素視為轉移抑制分子。
二、選擇素
選擇素(selectin)屬親異性CAM,其作用依賴於Ca2+。主要參與白細胞與脈管內皮細胞之間的識別與粘合。已知選擇素有三種:L選擇素、E選擇素及P選擇素。
選擇素的胞外區由三個結構域構成:N端的C型凝集素結構域,EGF樣結構域、重複次數不同的補體結合蛋白結構域;通過凝集素結構域來識別糖蛋白及糖脂分子上的糖配體。
E選擇素及P選擇素所識別與結合的糖配體為唾液酸化及岩藻糖化的N乙醯氨基乳糖結構(sLeX及sLeA)。sLeA結構存在於髓系白細胞表面(其中包括L選擇素)分子中。多種腫瘤細胞表面也存在sLeX及sLeA結構。
P選擇素貯存於血小板的α顆粒及內皮細胞的Weibel-Palade小體。炎症時活化的內皮細胞表面首先出現P選擇素,隨後出現E選擇素。它們對於召集白細胞到達炎症部位具有重要作用。
E選擇素存在於活化的血管內皮細胞表面。炎症組織釋放的白細胞介素I(IL-1)及腫瘤壞死因子(TNF)等細胞因子可活化脈管內皮細胞,刺激E選擇素的合成。
L選擇素廣泛存在於各種白細胞的表面,參與炎症部位白細胞的出脈管過程。白細胞表面L選擇素分子上的sLeA與活化的內皮細胞表面的P選擇素及E選擇素之間的識別與結合,可召集血液中快速流動的白細胞在炎症部位的脈管內皮上減速滾動(即通過粘附、分離、再粘附……,如此循環往複),最後穿過血管進入炎症部位。
炎症一開始即啟動白細胞的功能變化,各種選擇素均使血管中白細胞的運動減慢而形成滾動狀態,其中P-選擇素和L-選擇素在缺血-再灌注過程中的作用更大。
三、免疫球蛋白超家族
免疫球蛋白超家族(Ig-superfamily,Ig-SF)包括分子結構中含有免疫球蛋白(Ig)樣結構域的所有分子,一般不依賴於Ca2+。免疫球蛋白樣結構域系指借二硫鍵維繫的兩組反向平行β摺疊結構。
除免疫球蛋白外,還包括T細胞受體,B細胞受體,MHC及細胞粘附分子(Ig-CAM)等。有的屬於親同性CAM,如各種神經細胞粘附分子(N-CAM)及血小板-內皮細胞粘附分子(Pe-CAM);有的屬於親異性CAM,如細胞間粘附分子(I-CAM)及脈管細胞粘附分子(V-CAM)等。I-CAM及V-CAM的配體都是整合素。
N-CAM有20餘種異型分子,它們在神經發育及神經細胞間相互作用上有重要作用。
I-CAM及V-CAM在活化的血管內皮細胞表達。炎症時,活化的內皮細胞表面的I-CAM可與白細胞表面的αLβ2及巨噬細胞表面的αMβ2相結合;V-CAM則可與白細胞的α4β1整合素相結合。它們繼上述選擇素介導的白細胞與內皮細胞的粘合作用之後使在內皮上滾動的白細胞固著於炎症部位的脈管內皮,並發生鋪展,進而分泌水解酶而穿出脈管壁。
四、整合素
整合素(integrin)大多為親異性細胞粘附分子,其作用依賴於Ca2+。介導細胞與細胞間的相互作用及細胞與細胞外基質間的相互作用。幾乎所有動植物細胞均表達整合素。
整合素是由α (120~185kD)和β(90~110kD)兩個亞單位形成的異二聚體。迄今已發現16種α亞單位和9種β亞單位。它們按不同的組合構成20餘種整合素。
α亞單位的N端有結合二價陽離子的結構域,胞質區近膜處都有一個非常保守的KXGFFKR序列,與整合素活性的調節有關。
含β1亞單位的整合素主要介導細胞與細胞外基質成分之間的粘附。含β2亞單位的整合素主要存在於各種白細胞表面,介導細胞間的相互作用。β3亞單位的整合素主要存在於血小板表面,介導血小板的聚集,並參與血栓形成。除β4可與肌動蛋白及其相關蛋白質結合,α6β4整合素以層粘連蛋白為配體,參與形成半橋粒。
按β亞單位分類可分β1、β2、β3 3個亞家族。
β1亞家族稱為VLA(very late activation antigen)家族,含有VLA-1~6 6種整合素。VLA-1、2作為T細胞的後期活性化抗原而先被認定。而後的VLA-3、4、5、6因有同樣的β鏈故稱VLA-3、4、5、6。而實際上特別是VLA-4、5在靜止期的淋巴細胞中最高。
β2亞家族也稱CD18抗原,因白細胞上均有1個或多個β2整合素故稱白細胞整合素(leukocyte integrin)。包括3類糖蛋白:①淋巴細胞功能相關抗原-1(LFA-1):即CDⅡa/CD18,是白細胞上的粘附受體,參與白細胞與內皮細胞的粘附過程,能識別ICAMs。LFA-1與ICAMs的粘附受細胞激動的調節,參與中性白細胞、單核細胞和淋巴細胞向血管內皮的粘附。LFA-1還參與細胞毒性細胞與其靶細胞、NK細胞與其靶細胞的相互作用。②巨噬細胞分化抗原-1(Mac-1):Mac-1(CR3、CD11b/CD18)能與補體蛋白C3bi相作用,能識別纖維蛋白原和內皮細胞上1個尚未被鑒定的配子X及幾種微生物抗原。③p150.95(CD11c/CD18):其配體特異性還不清楚,但知其可參與細胞與內皮和細胞與表面結合的纖維蛋白原的相互作用。如缺乏可造成白細胞與內皮細胞粘附障礙,病人往往發生反覆感染,嚴重者可發生致命性的難以控制的敗血症而死亡[8]。
β3亞家族稱為細胞粘附素(cytoadhesion),含人玻璃粘蛋白受體(VNR)和血小板的gpⅡb/Ⅲa。
細胞粘附素按功能分類可分為2類:①存在於淋巴細胞上,通過與Ig家族中的CAM結合而介導異型性細胞間的粘附。②作為各種ECM的配體,介導細胞與ECM的粘附,從而控制細胞與基膜的結合,以及細胞的遊走。如在整合素β1和β3亞家族就有LN、CL、FN、FB、VN等ECM受體的機能。
五、透明質酸粘素
透明質酸粘素(hyaladherin)包括可結合透明質酸糖鏈的一類分子,具有相似的胺基酸序列和空間構象。CD44族是其中的一個成員,分子量範圍為85 KD~250KD,介導細胞與細胞間及細胞與細胞外基質間的相互作用,同樣是由胞外,跨膜及胞質三個部分構成的糖蛋白,糖鏈為硫酸軟骨素及硫酸乙醯肝素。CD44肽鏈的N端可結合透明質酸,故CD44也被視為透明質酸的受體。
CD44的功能包括: ①與透明質酸、纖粘連蛋白及膠原結合,介導細胞與細胞外基質之間的粘附;②參與細胞對透明質酸的攝取及降解;③參與淋巴細胞歸巢;④參與T細胞的活化;⑤促進細胞遷移。
CD44在很多種腫瘤細胞的表達比相應正常組織為高,並與腫瘤細胞的成瘤性、侵襲性及淋巴結轉移性有關。
細胞粘附分子的研究及發展
CAM群的發展:CAM曾指層粘連蛋白(LN)和纖維粘連蛋白(FN)等構成細胞外基質(ECM)的蛋白質。近來CAM才被明確認為是一群分子家族。特別是ECM受體群的發現,揭示了CAM是數目繁多的大家族。因CAM範疇的分子在體外培養中均顯示出細胞的粘附活性,故稱CAM。但其在體內的作用機制還不完全明確。
CAM的研究方向:CAM在細胞間的連接方式是研究之一。同種細胞間以同種CAM連接稱同種連接,細胞間以異種CAM連接稱異種連接。同種連接中有名的是神經細胞粘附分子(NCAM)和鈣依賴性粘附素(adhenin),其他的連接方式多是異種連接。
CAM生理作用是研究之二。細胞粘附是細胞維持形態結構與功能的生物現象。以前CAM多指細胞膜上的跨膜蛋白,如thy-1和LFA-3。現認為CAM並不是單純結構性的起連接作用,而是通過細胞間的機械性連接來識別外界,或是將外界的信息傳達到細胞內。如跨膜蛋白中含有濃縮的酪氨酸激酶,說明CAM間有信息傳遞的功能。
近年通過單克隆技術已鑒定出多種與細胞粘附有關的CAM,已知的CAM可分5個超級家族。隨著不斷研究將有更多的CAM被鑒定和闡明。
細胞粘附分子表達數量改變對粘附作用的調節
粘附分子表達數量的改變是粘附作用調節的另一個重要方面。粘附分子構型改變與表達數量的增減並不是截然分開的兩個過程,兩者可能同時存在,共同完成對粘附作用的調節。如淋巴細胞活化後不僅粘附分子構型改變導致親和力增加,同時也伴有粘附分子數量的增加。
1. 調節細胞表面粘附分子表達數量的方式
細胞表面粘附分子表達數量的調節方式主要有誘導貯存在細胞內的粘附分子轉移到細胞表面和誘導粘附分子的重新合成兩種方式。轉移形式的過程發生迅速,只需數秒鐘,但維持時間短暫。如凝血酶和組胺作用於內皮細胞可以誘導內皮細胞內貯存的CD62分子迅速轉移到細胞表面,然後又很快被內吞而消失; 又如CD11b/CD18、CD11c/CD18貯存在中性粒細胞的胞漿顆粒內,在PMA、TNF、IL-1刺激後迅速轉移到細胞表面。重新合成過程發生較為遲緩,一般需數小時,但維持時間較長。IL-1、TNF-α作用於血管內皮細胞則可以誘導E-selectin、VCAM-1分子的重新合成與表達, 誘導後4小時達到高峰,並可維持24小時以上。
2. 細胞因子、炎症介質對粘附分子表達的調節
細胞因子IL-1、IL-3、IL-4、IL-8、PAF、GM-CSF、TNF-α、TNF-β和IFN-γ以及炎症介質白三烯、組胺和凝血酶等可作用於白細胞或/和血管內皮細胞, 調節白細胞與血管內皮細胞的粘附作用(表2-6)。在體內可能有多種調節因素同時存在,相互影響,並可能有更多的目前未知的因素參與細胞間粘附的調節過程。
3. 細胞的生長、發育狀態對粘附分子表達的影響
除了上述細胞因子、炎症介質可以調節細胞粘附分子的表達外,細胞本身的生長、發育、分化及代謝狀態也可以影響粘附分子的表達。在胚胎髮育過程中,組織細胞粘附分子的表達按一定的規律發生改變,使得不同細胞得以按一定的規律組合在一起,形成不同的組織或器官。腫瘤細胞與其起源的正常組織細胞相比其表達的粘附分子可有很大差異,這可能是某些腫瘤細胞易發生浸潤、轉移等現象的分子基礎。此外,處於不同分化和發育狀態的淋巴細胞表達粘附分子也有明顯改變,如與未經抗原刺激的T細胞(naive T cell)相比,記憶性T細胞(memory T cell)表達更多的CD2、LFA-1、CD44、VLA-4等粘附分子,而L-selectin在naive T細胞表達水平要明顯高於記憶T細胞。
| 關於「細胞粘附分子」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |