病理生理學/血細胞大量破壞
| 醫學電子書 >> 《病理生理學》 >> 彌散性血管內凝血 >> 彌散性血管內凝血的原因和發病機制 >> 血細胞大量破壞 |
| 病理生理學 |
|
|
紅細胞大量破壞時常可發生DIC。急性溶血,如大量(>50ml)誤型輸血、藥物引起的免疫性溶血時,抗原-抗體複合物的形成對凝血起主要作用。因為據報導,在蠶豆病中由非免疫因素引起的血管內溶血以及實驗性血紅蛋白尿等情況下常常不產生DIC。因此,一般認為只有在紅細胞大量破壞伴有較強的免疫反應時,DIC才比較容易發生。此外,紅細胞大量破壞釋出的ADP與DIC的發生有關,因為後者觸動了血小板釋放反應,使大量血小板第3因子(PF3)入血,促進凝血過程。紅細胞膜內大量的磷脂既有直接的促凝作用,又能促進血小板的釋放而間接促進凝血過程。
實驗研究證明,正常的中性粒細胞和單核細胞內有促凝物質。在內毒素或敗血症所引起的DIC時內毒素可使中性粒細胞合成並釋放組織因子,同時有大量白細胞在肺血管中停滯,並釋放出大量促凝物質(可能就是組織因子),這些物質進入體循環進一步加速了凝血反應,所以肺似乎起了凝血的放大作用。大量促凝物質從崩解的白細胞中釋放出來,從肺血管經左心進入主動脈後,腎臟首先受累,因此腎臟微血栓發生率較高,病變程度較重。另外,在病人患急性早幼粒細胞性白血病時,此類白血病細胞漿中含有凝血活酶樣物質,當白血病細胞大量壞死或經化療殺傷時,這些物質就大量釋放入血,通過外源性凝血系統的啟動而引起DIC。
血小板在DIC的發生髮展中起著重要的作用。內毒素、免疫複合物、顆粒物質、凝血酶等都可直接損傷血小板,促進它的聚集。微血管內皮細胞的損傷,內皮下膠原和微纖維的暴露是引起局部血小板粘附、聚集、釋放反應的主要原因,這是因為是構成膠原的肽鏈中,存在著一個與血小板粘附有關的活性部位。血小板表面的糖蛋白Ib(glycoprotein Ib, GPIb)對血小板粘附起重要作用,GPIb通過血漿因子(如Ⅷ相關抗原/vonWillebrand因子,Ⅷ/VWF因子)使血小板與內皮下組織粘連。另外,由於血小板膜上的另一些糖蛋白(GPⅡb,GPⅡa)能結合於纖維蛋白原,後者通過與鈣離子的連接,在血小板之間「搭橋」,使血小板聚集。血小板發生粘附、釋放和聚集後,除有血小板微集物形成(microaggregateformation,圖9-2)堵塞微血管外,還能進一步激活血小板的凝血活性,促進DIC的形成。但是在不同病因所引起的DIC中,血小板所發揮的作用並不一致,它可以起原發的作用,如血栓性血小板減少性紫癜,在發病開始時即可由免疫反應等原因使血小板發生聚集,其中PF3(血小板第3因子)能加速凝血酶原的激活,PF4(血小板第4因子)能中和肝素並使可溶性纖維蛋白多聚體沉澱。β-血栓球蛋白也具有促凝作用,從而加速血液凝固,形成微血栓。但是,一般來說,在DIC發病中,血小板多起繼發的作用。在外源性凝血系統被激活所致的DIC中,血小板不起主要作用,在內毒素引起的DIC中,血小板對白細胞的促凝機制還有促進作用。實驗證明,人類白細胞與內毒素同時孵育後所產的促凝活性可因加入血小板而增強,這可能是血小板膜上的脂蛋白、白細胞及某些凝血因子相互作用造成的。
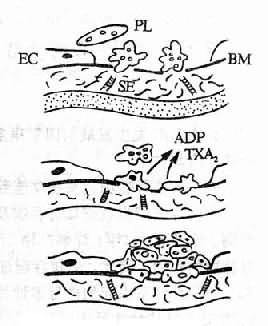
圖9-2 血小板微聚物形成機制示意圖
| 關於「病理生理學/血細胞大量破壞」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |