生物化學與分子生物學/蛋白質的二級結構
| 醫學電子書 >> 《生物化學與分子生物學》 >> 蛋白質化學 >> 蛋白質的結構及其功能 >> 蛋白質的空間結構 >> 蛋白質的二級結構 |
| 生物化學與分子生物學 |
|
|
蛋白質的二級結構(secondarystructure)是指多肽鏈中主鏈原子的局部空間排布即構象,不涉及側鏈部分的構象。
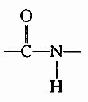
1.肽鍵平面(或稱醯胺平面,amide plane)。
Pauling等人對一些簡單的肽及胺基酸的醯胺等進行了X線衍射分析,得出圖1-2所示結構,從一個肽鍵的周圍來看,得知:
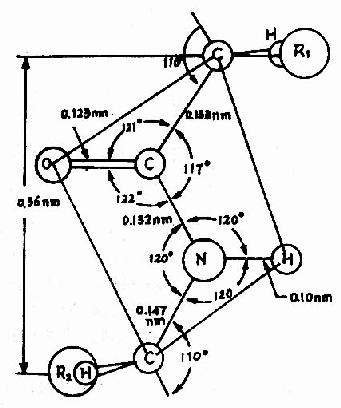
圖1-2 肽鍵平面示意圖
(1)
 中的C-N鍵長0.132nm,比相鄰的N-C單鍵(0.147nm)短,而較一般C=N雙鍵(0.128nm)長,可見,肽鍵中-C-N-鍵的性質介於單、雙鍵之間,具有部分雙鍵的性質,因而不能旋轉,這就將固定在一個面之內。
中的C-N鍵長0.132nm,比相鄰的N-C單鍵(0.147nm)短,而較一般C=N雙鍵(0.128nm)長,可見,肽鍵中-C-N-鍵的性質介於單、雙鍵之間,具有部分雙鍵的性質,因而不能旋轉,這就將固定在一個面之內。
(2)
 肽鍵的C及N周圍三個鍵角之和均為360°,說明都處於一個面上,也就是說
肽鍵的C及N周圍三個鍵角之和均為360°,說明都處於一個面上,也就是說
 六個原子基本上同處於一個平面,這就是肽鍵平面。肽鏈中能夠旋轉的只有α碳原子所形成的單鍵,此單鍵的旋轉決定兩個肽鍵平面的位置關係,於是肽鍵平面成為肽鏈盤曲摺疊的基本單位。
六個原子基本上同處於一個平面,這就是肽鍵平面。肽鏈中能夠旋轉的只有α碳原子所形成的單鍵,此單鍵的旋轉決定兩個肽鍵平面的位置關係,於是肽鍵平面成為肽鏈盤曲摺疊的基本單位。
(3) 肽鍵中的C-N既具有雙鍵性質,就會有順反不同的立體異構,已證實
 處於反位(見圖1-3)。
處於反位(見圖1-3)。
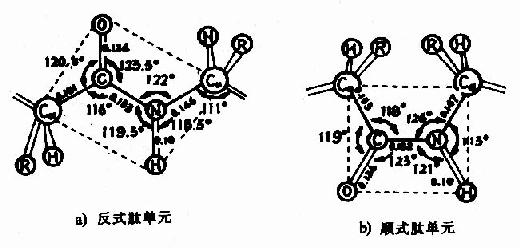
圖1-3 反式肽單元和順式肽單元
2.蛋白質主鏈構象的結構單元
1)α-螺旋Pauling等人對α-角蛋白(α-keratin)進行了X線衍射分析,從衍射圖中看到有0.5~0.55nm的重複單位,故推測蛋白質分子中有重複性結構,並認為這種重複性結構為α-螺旋(α-helix)見圖1-4。
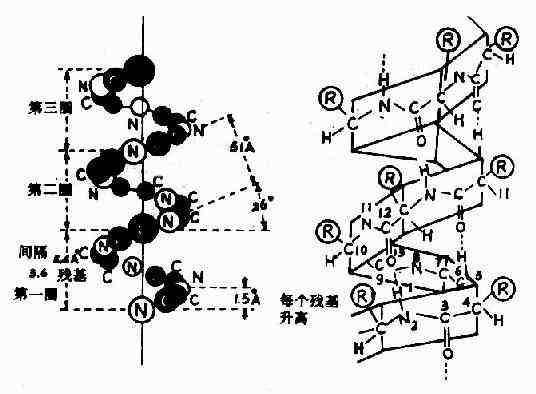
圖1-4 蛋白質分子的α-螺旋
α-螺旋的結構特點如下:
(1)多個肽鍵平面通過α-碳原子旋轉,相互之間緊密盤曲成穩固的右手螺旋。
(2)主鏈呈螺旋上升,每3.6個胺基酸殘基上升一圈,相當於0.54nm,這與X線衍射圖符合。
(3)相鄰兩圈螺旋之間借肽鍵中C=O和H桸形成許多鏈內氫健,即每一個胺基酸殘基中的NH和前面相隔三個殘基的C=O之間形成氫鍵,這是穩定α-螺旋的主要鍵。
(4)肽鏈中胺基酸側鏈R,分布在螺旋外側,其形狀、大小及電荷影響α-螺旋的形成。酸性或鹼性胺基酸集中的區域,由於同電荷相斥,不利於α-螺旋形成;較大的R(如苯丙氨酸、色氨酸、異亮氨酸)集中的區域,也妨礙α-螺旋形成;脯氨酸因其α-碳原子位於五元環上,不易扭轉,加之它是亞胺基酸,不易形成氫鍵,故不易形成上述α-螺旋;甘氨酸的R基為H,空間佔位很小,也會影響該處螺旋的穩定。
2)β-片層結構Astbury等人曾對β-角蛋白進行X線衍射分析,發現具有0.7nm的重複單位。如將毛髮α-角蛋白在濕熱條件下拉伸,可拉長到原長二倍,這種α-螺旋的X線衍射圖可改變為與β-角蛋白類似的衍射圖。說明β-角蛋白中的結構和α-螺旋拉長伸展後結構相同。兩段以上的這種摺疊成鋸齒狀的肽鏈,通過氫鍵相連而平行成片層狀的結構稱為β-片層(β-pleatedsheet)結構或稱β-摺疊(圖1-5)。
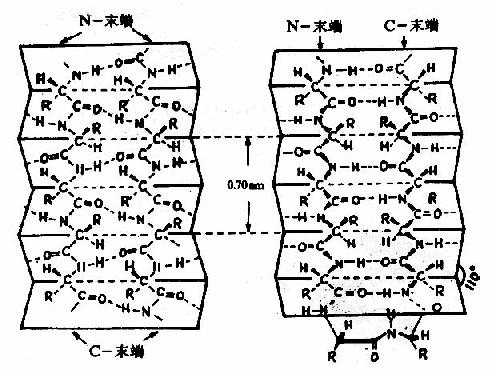
圖1-5 蛋白質分子中的β-片層結構
左:順向平行 右:逆向平行
β-片層結構特點是:
①是肽鏈相當伸展的結構,肽鏈平面之間摺疊成鋸齒狀,相鄰肽鍵平面間呈110°角。胺基酸殘基的R側鏈伸出在鋸齒的上方或下方。
②依靠兩條肽鏈或一條肽鏈內的兩段肽鏈間的C=O與H梄形成氫鍵,使構象穩定。
③兩段肽鏈可以是平行的,也可以是反平行的。即前者兩條鏈從「N端」到「C端」是同方向的,後者是反方向的。β-片層結構的形式十分樣,正、反平行能相互交替。
④平行的β-片層結構中,兩個殘基的間距為0.65nm;反平行的β-片層結構,則間距為0.7nm。
3)β-轉角
蛋白質分子中,肽鏈經常會出現180°的回折,在這種回折角處的構象就是β-轉角(β-turn或β-bend)。β-轉角中,第一個胺基酸殘基的C=O與第四個殘基的N桯形成氫鍵,從而使結構穩定(圖1-6)。
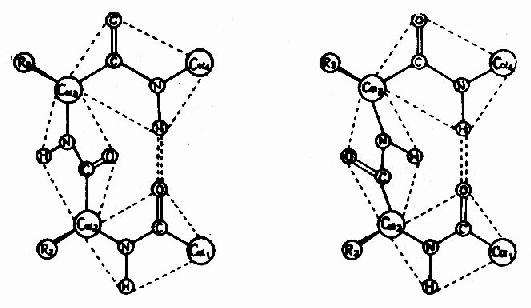
圖1-6 蛋白質分子中的β-轉角
4)無規捲曲
沒有確定規律性的部分肽鏈構象,肽鏈中肽鍵平面不規則排列,屬於鬆散的無規捲曲(random coil)。
| 關於「生物化學與分子生物學/蛋白質的二級結構」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |