生物化學與分子生物學/蛋白質的三級結構
| 醫學電子書 >> 《生物化學與分子生物學》 >> 蛋白質化學 >> 蛋白質的結構及其功能 >> 蛋白質的空間結構 >> 蛋白質的三級結構 |
| 生物化學與分子生物學 |
|
|
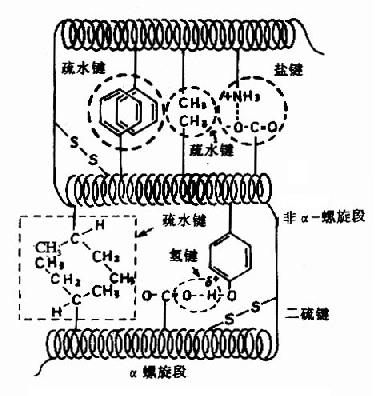
圖1-8 蛋白質三級結構中某些次級鍵
蛋白質的多肽鏈在各種二級結構的基礎上再進一步盤曲或摺疊形成具有一定規律的三維空間結構,稱為蛋白質的三級結構(tertiary structure)。蛋白質三級結構的穩定主要靠次級鍵,包括氫鍵、疏水鍵、鹽鍵以及范德華力(Van der Wasls力)等(圖1-8)。這些次級鍵可存在於一級結構序號相隔很遠的胺基酸殘基的R基團之間,因此蛋白質的三級結構主要指胺基酸殘基的側鏈間的結合。次級鍵都是非共價鍵,易受環境中pH、溫度、離子強度等的影響,有變動的可能性。二硫鍵不屬於次級鍵,但在某些肽鏈中能使遠隔的二個肽段聯繫在一起,這對於蛋白質三級結構的穩定上起著重要作用。
現也有認為蛋白質的三級結構是指蛋白質分子主鏈摺疊盤曲形成構象的基礎上,分子中的各個側鏈所形成一定的構象。側鏈構象主要是形成微區(或稱結構域domain)。對球狀蛋白質來說,形成疏水區和親水區。親水區多在蛋白質分子表面,由很多親水側鏈組成。疏水區多在分子內部,由疏水側鏈集中構成,疏水區常形成一些「洞穴」或「口袋」,某些輔基就鑲嵌其中,成為活性部位。
具備三級結構的蛋白質從其外形上看,有的細長(長軸比短軸大10倍以上),屬於纖維狀蛋白質(fibrous protein),如絲心蛋白;有的長短軸相差不多基本上呈球形,屬於球狀蛋白質(globular protein),如血漿清蛋白、球蛋白、肌紅蛋白,球狀蛋白的疏水基多聚集在分子的內部,而親水基則多分布在分子表面,因而球狀蛋白質是親水的,更重要的是,多肽鏈經過如此盤曲後,可形成某些發揮生物學功能的特定區域,例如酶的活性中心等。
出自A+醫學百科 「生物化學與分子生物學/蛋白質的三級結構」條目 http://cht.a-hospital.com/w/%E7%94%9F%E7%89%A9%E5%8C%96%E5%AD%A6%E4%B8%8E%E5%88%86%E5%AD%90%E7%94%9F%E7%89%A9%E5%AD%A6/%E8%9B%8B%E7%99%BD%E8%B4%A8%E7%9A%84%E4%B8%89%E7%BA%A7%E7%BB%93%E6%9E%84 轉載請保留此連結
| 關於「生物化學與分子生物學/蛋白質的三級結構」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |