核糖核苷酸還原酶
| A+醫學百科 >> 核糖核苷酸還原酶 |
| ribonucleoside-diphosphate reductase | |||||||
|---|---|---|---|---|---|---|---|
|
|||||||
| 識別碼 | |||||||
| EC編號 | 1.17.4.1 | ||||||
| CAS號 | 9047-64-7sy | ||||||
| 資料庫 | |||||||
| IntEnz | IntEnz瀏覽 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme瀏覽 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代謝路徑 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBe PDBsum | ||||||
| 基因本體 | AmiGO / EGO | ||||||
|
|||||||
核糖核苷酸還原酶 (英文:Ribonucleotide reductase.(RNR), 別稱為 核糖核苷二磷酸還原酶) 他是一個酵素,功能為把核苷酸催化為脫氧核糖核苷酸.[1] 脫氧核糖核苷酸常被使用於DNA的合成。而且在活體中物中,這個藉由核糖核苷酸還原酶來催化的反應,受到非常嚴格的調控管理。[2] 此外,核糖核苷酸還原酶在調節DNA的合成的總速率中扮演一個非常關鍵的角色,可以讓我們在細胞分裂和DNA 複製時,DNA和細胞質量維持在固定比率。[3]核糖核苷酸還原酶還有一個比較特別的調控方法,就是藉由自由基機制來進行反應。[4][5]核糖核苷酸還原酶的基質有 ADP, GDP, CDP and UDP. dTDP (脫氧胸苷二磷酸)是從dTMP (脫氧胸苷一磷酸)而來,藉由(胸苷激酶)催化而形成.
目錄 |
結構
核糖核苷酸還原酶是一個鐵離子依賴型的酵素,而且此酵素在DNA的合成中是一個必要的角色。第一型的核糖核苷酸還原酶是由一個比較大的RNR1和一個比較小的RNR2,這兩個亞基所形成一個異二聚體四聚體。由於核糖核苷酸還原酶可以催化脫氧核糖核苷酸(dNTPs)的從頭反應,脫氧核糖核苷酸是DNA合成的前驅物,在細胞增殖中是一個必要的一員。
在人體中,RNR1亞基是由RRM1基因來編碼,同時他的異構型態RNR2是由RRM2基因和RRM2B基因來編碼的:
- 1.含有220[[N-terminus|N-端]殘基的主要螺旋結構。
- 2.包含480個殘基,有十股α/β的結構。
- 3.包含70個殘基比較小一點,有五股 α/β的結構。
在Pfam中,第二域名已被解釋為兩個單獨的域:
- 1.一個比較小,全部由α組成的N端域。
- 2.一個比較大,全部由β組成的C端域。
RNR2含有一個亞鐵中心和一個穩定的酪氨醯 自由基. 在Escherichia coli|大腸桿菌中,酪氨醯自由基位於Y12) 提供穩定的自由基給第一型的RNR2亞基。[7] 在 Aedes aegypti|埃及斑蚊體中, 酪氨醯自由基位於位置Y184。[8] 酪氨醯自由基通常被深深的埋在蛋白質的疏水環境中,而這個地方通常是在常使用穩定酪氨醯自由基的鐵離子中心旁邊。 2μ-氧聯鐵杆的結構是由鐵結合位點的配體所提供的: 有4個胺基酸[天冬氨酸 (D146), 谷氨酸 (E177, E240, and E274)] 和兩個組氨酸s (H180 and H277).[8] 發生在RNR2的C端和RNR1的C端的關聯之間。[6] 酵素的活性依賴於RNR1和RNR2這兩個基質的關聯性。 活化中心包含從亞鐵中心(RN1R)來的活化雙硫醇基團和從RNR2亞基來的酪氨醯自由基。
RNR2的其他殘基, 如天冬氨酸(D273), 色氨酸 (W48),和和酪氨酸(Y356) 可以進一步穩定活化中心的酪氨醯自由基,來進行我們的電子轉移。[6] 這些殘基有助於從酪氨酸RNR2(Y122)轉移字由基給半胱氨酸RNR1(C439)。電子的轉移從RNR2酪氨酸(Y122)開始,而且繼續從RNR2到色氨酸(W48),這些都是藉由2.5奈米的RNR1酪氨酸(Y731)分離而來的。在活化位中,電子由RNR1轉移到RNR2且經過酪氨酸(Y356 to Y731)然後再透過酪氨酸(Y730)到半胱氨酸(C439)。[9] RNR一級結構的的定點突變指出我們上述的那些殘基全部都有參雨我們把自由基傳頌到活化位的長距離運輸。[6]
在埃及斑蚊中, RNR1保留最關鍵的胺基酸殘基,比如天門冬氨酸(D64)和纈氨酸(V292 or V284),這些胺基酸異位調節中都是非常重要的; 脯氨酸 (P210 and P610), 亮氨酸 (L453 and L473)和甲硫氨酸 (M603)殘基都是座落在疏水部分的活化位;半胱氨酸(C225, C436 and C451)殘基會在活化位中參與去除氫原子和轉移自由基電子;半胱氨酸 (C225 and C436), 天冬醯胺 (N434)和谷氨酸 (E441)殘基與核糖基質結合;酪氨酸(Y723 and Y743)殘基決定自由基的轉移;半胱氨酸(C838 and C841)殘基在活化位被用來再生雙硫醇基團。[8]
功能
核糖核苷酸還原酶(RNR)這個酵素從頭催化dNTPs。[10]核糖核苷5'-二磷酸(NDPs)催化核糖5 - 磷酸2號碳的環原反應,形成2'-脫氧衍生物還原2'-脫氧核糖核苷5'-二磷酸(dNDPs)。而這個反應在我產生自由基的時候會啟動。由單一的反應來,RNR需要硫氧還原蛋白的雙硫醇基團所提供的電子。當煙醯胺腺嘌呤二核苷酸磷 (NADPH)提供兩個氫原子來環原硫氧還原蛋白的二硫化物基團時,我們的硫氧環原蛋白會進行再生。
三個類型的RNR都有非常相像的機制來還原NDPs,三者的不同處只在於產生自由基的部分。金屬蛋白的結構中含有特定的金屬離子和電子提供者,所有類型都是使用自由基化學。[6] 第一型的還原酶使用亞鐵離子中心和三價鐵轉化為游離的酪氨醯自由基,通常還原NDP基質都要在有氧的情況下進行。第一型的還原酵素貝分為IA和IB兩類型,分配管制不同的調節作用。IA型還原酶通常分布在真核生物,真細菌, 噬菌體,和病毒中.而IB型的還原酶則被發現在真細菌中。 IB型還原酶也可以藉由雙核錳中心穩定的產生自由基。
還原反應的催化機制
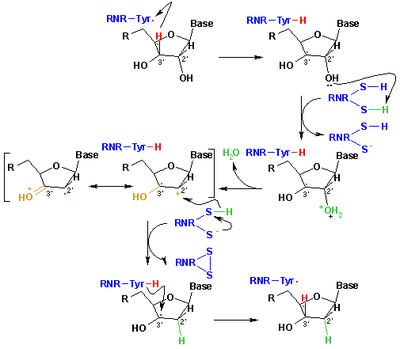
核糖核苷酸變成脫氧核糖核苷酸的這個還原機制就是我們的下圖。第一步驟我們先把3'-H的基質1'通過自由基Cys439。然後藉由Cys225和Glu441的催化把核糖核苷酸的2號碳位子消除一個水分子。第三個步驟在之前的質子從Cys462轉移到Cys225後,氫原子從Cys225轉移到2'-羰自由基3的2號碳位子。在最後一個步驟中,獲得陰離子的自由基雙硫橋和和閉殼層酮中間體4。在幾個2'-取代基的類似物的轉化過程中這個中間物被確定,以及和酶的突變體作用過的天然基質。[11] 可以藉由Cerqueira 等人的研究來了一些使用整個R1蛋白的機制.[12][13]
調節
第一型RNR包含了RNR1和RNR2兩個亞基,和形成異源二聚體的四聚體有關。[4] RNR1包含變構點,還有調節基質特異性和活性的功能。 4個核糖核苷酸的期中一個接合上活性位,取決於變構的配製。
RNR的調節是為了維持dNTPs的量。當ATP結合上異構活化位時會活化RNR。相反的,當dATP結合到異構活化位時,RNR會失去活性。[6]除了控制活性外,這種異位調節機制,還可以調節基質的專一性還有確保酵素所製造的dNTP是等量的。[6]所有的種類在異構為上結合ATP或dATP都會誘導胞苷5'-二磷酸(CDP)和尿苷5'-二磷酸(UDP)的還原;2'-脫氧鳥苷-5'-三(三磷酸)誘導還原腺苷5'-二磷酸(ADP); 2'-脫氧胸苷5'-三磷酸(dTTP的)誘導還原5'-鳥苷二磷酸(GDP)。
有趣的是,IB型的還原酶不會被dATP抑制因為他們在異構活化位上缺乏了大概50個N端的胺基酸。[14]真核細胞的IA型還原酶有一個附調控機制,就是當dNTPs濃度過高時,他會關閉她的合成機制。.這個機制可以保護我們的細胞不會因為dNTP的過剩造成的細胞毒性或突變效應而造成細胞死亡或DNA的損害。[15][16]
RNR 可以使用異位調節的morpheein模型.[17]
RNR1和RNR2抑制劑
通常類型I的RNR抑制劑可以被分成三種:轉譯抑制劑,可以中止酵素的合成。二聚化抑制劑,可以預防兩個RNR亞基的關聯(R1和R2)。最後是催化抑制劑可以讓R1亞基或R2亞基失活。.[12]
第一型的RNR和第二型的RNR的C端很像,都可以被肽類抑制。
參考資料
- ↑ Elledge SJ, Zhou Z, Allen JB. Ribonucleotide reductase: regulation, regulation, regulation. Trends Biochem. Sci.. March 1992, 17 (3): 119–23. doi:10.1016/0968-0004(92)90249-9. PMID 1412696.
- ↑ Torrents E, Aloy P, Gibert I, Rodríguez-Trelles F. Ribonucleotide reductases: divergent evolution of an ancient enzyme. J. Mol. Evol.. August 2002, 55 (2): 138–52. doi:10.1007/s00239-002-2311-7. PMID 12107591.
- ↑ Herrick J, Sclavi B. Ribonucleotide reductase and the regulation of DNA replication: an old story and an ancient heritage. Mol. Microbiol.. January 2007 pmid = 17229208, 63 (1): 22–34. doi:10.1111/j.1365-2958.2006.05493.x.
- ↑ 4.0 4.1 Eklund H, Eriksson M, Uhlin U, Nordlund P, Logan D. Ribonucleotide reductase--structural studies of a radical enzyme. Biol. Chem.. August 1997, 378 (8): 821–5. PMID 9377477.
- ↑ Stubbe J, Riggs-Gelasco P. Harnessing free radicals: formation and function of the tyrosyl radical in ribonucleotide reductase. Trends Biochem. Sci.. November 1998, 23 (11): 438–43. doi:10.1016/S0968-0004(98)01296-1. PMID 9852763.
- ↑ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 Jordan A, Reichard P. Ribonucleotide reductases. Annu. Rev. Biochem.. 1998, 67 (1): 71–98. doi:10.1146/annurev.biochem.67.1.71. PMID 9759483.
- ↑ Högbom M, Andersson ME, Nordlund P. Crystal structures of oxidized dinuclear manganese centres in Mn-substituted class I ribonucleotide reductase from Escherichia coli: carboxylate shifts with implications for O2 activation and radical generation. J. Biol. Inorg. Chem.. March 2001, 6 (3): 315–23. doi:10.1007/s007750000205. PMID 11315567.
- ↑ 8.0 8.1 8.2 Pham DQ, Blachuta BJ, Nichol H, Winzerling JJ. Ribonucleotide reductase subunits from the yellow fever mosquito, Aedes aegypti: cloning and expression. Insect Biochem. Mol. Biol.. September 2002, 32 (9): 1037–44. doi:10.1016/S0965-1748(02)00041-3. PMID 12213240.
- ↑ Chang MC, Yee CS, Stubbe J, Nocera DG. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC406436/ Turning on ribonucleotide reductase by light-initiated amino acid radical generation]. Proc. Natl. Acad. Sci. U.S.A.. May 2004, 101 (18): 6882–7. doi:10.1073/pnas.0401718101. PMID 15123822. PMC 406436.
- ↑ Cox, Michael; Nelson, David R.. Lehninger Principles of Biochemistry. San Francisco: W. H. Freeman. 2008. ISBN 0-7167-7108-X.
- ↑ Cerqueira NM, Fernandes PA, Eriksson LA, Ramos MJ. Ribonucleotide activation by enzyme ribonucleotide reductase: understanding the role of the enzyme. J Comput Chem. December 2004, 25 (16): 2031–7. doi:10.1002/jcc.20127. PMID 15481089.
- ↑ 12.0 12.1 Cerqueira NM, Pereira S, Fernandes PA, Ramos MJ. Overview of ribonucleotide reductase inhibitors: an appealing target in anti-tumour therapy. Curr. Med. Chem.. 2005, 12 (11): 1283–94. doi:10.2174/0929867054020981. PMID 15974997.
- ↑ Cerqueira NM, Fernandes PA, Eriksson LA, Ramos MJ. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC1386789/ Dehydration of ribonucleotides catalyzed by ribonucleotide reductase: the role of the enzyme]. Biophys. J.. March 2006, 90 (6): 2109–19. doi:10.1529/biophysj.104.054627. PMID 16361339. PMC 1386789.
- ↑ Eliasson R, Pontis E, Jordan A, Reichard P. Allosteric regulation of the third ribonucleotide reductase (NrdEF enzyme) from enterobacteriaceae. J. Biol. Chem.. October 1996, 271 (43): 26582–7. doi:10.1074/jbc.271.43.26582. PMID 8900130.
- ↑ Kunz BA. Mutagenesis and deoxyribonucleotide pool imbalance. Mutat. Res.. 1988, 200 (1-2): 133–47. doi:10.1016/0027-5107(88)90076-0. PMID 3292903.
- ↑ Meuth M. The molecular basis of mutations induced by deoxyribonucleoside triphosphate pool imbalances in mammalian cells. Exp. Cell Res.. April 1989, 181 (2): 305–16. doi:10.1016/0014-4827(89)90090-6. PMID 2647496.
- ↑ T. Selwood and E. K. Jaffe.. Dynamic dissociating homo-oligomers and the control of protein function.. Arch. Biochem. Biophys.. 2011, 519 (2): 131–43. doi:10.1016/j.abb.2011.11.020. PMID 22182754. PMC 3298769.
外部連結
|
||||||||||||||||||||||||||
參考來源
| 關於「核糖核苷酸還原酶」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |