原代培養
| A+醫學百科 >> 原代培養 |
原代培養是指直接從機體取下細胞、組織和器官後立即進行培養。因此,較為嚴格地說是指成功傳代之前的培養,此時的細胞保持原有細胞的基本性質,如果是正常細胞,仍然保留二倍體數。但實際上,通常把第一代至第十代以內的培養細胞統稱為原代細胞培養。最常用的原代培養有組織塊培養和分散細胞培養。
目錄 |
基本介紹(primary culture)
原代培養也稱初代培養,嚴格的說即從體內取出組織接種培養到第一次傳代階段,但實際上,通常把第一代
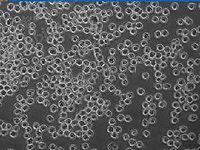
至第十代以內的培養細胞統稱為原代細胞培養。一般持續1一4周。此期細胞呈活躍的移動,可見細胞分裂,但不旺盛。初代培養細胞與體內原組織在形態結構和功能活動上相似性大。細胞群是異質的(Heterogeneous),也即各細胞的遺傳性狀互不相同,細胞相互依存性強。如把這種細胞群稀釋分散成單細胞,在軟瓊脂培養基中進行培養時,細胞克隆形成率(Cloning Efficiency)很低,即細胞獨立生存性差。克隆形成率即細胞群被稀釋分散成單個細胞進行培養時,形成細胞小群(克隆)的百分數。初代培養細胞多呈二倍體核型;由於原代培養細胞和體內細胞性狀相似性大,是檢測藥物很好的實驗對象。
也稱初代培養,即從體內取出組織接種培養到第一次傳代階段,一般持續1一4周。此期細胞呈活躍的移動,可見細胞分裂,但不旺盛。初代培養細胞與體內原組織在形態結構和功能活動上相似性大。細胞群是異質的(Heterogeneous),也即各細胞的遺傳性狀互不相同,細胞相互依存性強。如把這種細胞群稀釋分散成單細胞,在軟瓊脂培養基中進行培養時,細胞克隆形成率(Cloning Efficiency)很低,即細胞獨立生存性差。克隆形成率即細胞群被稀釋分散成單個細胞進行培養時,形成細胞小群(克隆)的百分數。初代培養細胞多呈二倍體核型;由於原代培養細胞和體內細胞性狀相似性大,是檢測藥物很好的實驗對象。
分類
最常用的原代培養有組織塊培養和分散細胞培養。
組織塊培養是將剪碎的組織塊直接移植在培養瓶壁上,加入培養基後進行培養。
分散細胞培養則是將組織塊用機械法或化學法使細胞分散。如欲從胎兒或新生兒的組織分離到活性最好的游離細胞,經典的方法是用蛋白水解酶(如胰蛋白酶和膠原酶)消化細胞間的結合物,或用金屬離子螯合劑(如EDTA)除去細胞互相粘著所依賴的Ca2+,再經機械輕度振蕩,使之成為單細胞。
實驗
實驗目的
能獨立地進行細胞的原代培養,爭取原代培養一次成功。
實驗原理
細胞培養是生物學和醫學研究最常用的手段之一,可分為原代培養和傳代培養兩種。原代培養是直接從生物體獲取細胞進行培養。由於細胞剛剛從活體組織分離出來,故更接近於生物體內的生活狀態。這一方法可為研究生物體細胞的生長、代謝、繁殖提供有力的手段,同時也為以後傳代培養創造條件。利用此方法還可直接服務於臨床實踐。例如,用從手術中切除的腫瘤細胞進行原代培養,然後用該培養細胞進行抗癌藥物的篩選,根據腫瘤細胞對加入的化療藥物的敏感性來幫助選擇最有效的化療方案,有可能起到增強療效、降低副作用的作用。原代培養可分為消化法和組織塊培養法,這裡統一作介紹。
實驗材料和用品
材料:培養瓶,青黴素瓶,小玻璃漏斗,三角燒瓶,平皿,吸管,試管,移液管,無菌紗布,無菌眼科剪,廢液缸,血球計數板,蠟盤,手術器械,大頭針,離心管。孕鼠或新生1。4d乳鼠,75%酒精棉球,2%碘酒。
藥品:培養基(RPMI1640或DMEM),小牛血清,0.125%胰蛋白酶,Hanks液,75%酒精,雙抗(青黴素和鏈黴素)。
儀器(請參看儀器圖庫):CO2培養箱.;倒置顯微鏡,超淨台,磁力攪拌器,離心機。
實驗步驟
1.取材(以胚胎小鼠為例):將孕鼠拉頸椎處死,投入75%酒精浸泡數秒消毒,提出孕鼠控掉酒精,放置於蠟盤中用大頭針固定。用手術器械逐層分離皮膚和肌肉組織,打開腹腔。注意不同的解剖層次使用不同的消毒器械。最後取出雙角子宮置於無菌平皿內。
2.用Hanks液洗滌3次,剪開子宮取出胚胎。除去子宮、血液和筋膜等組織。
3.用彎頭剪把胚胎盡量剪碎,每個組織塊小於1mm3。在操作時應盡量將平皿蓋半蓋住平皿以防空氣中塵埃落下污染組織。再用Hanks液洗滌2-3次,自然沉澱。用吸管吸去上清液。以下可按兩種方法進行,即消化法和組織塊培養法。
4.若使用消化法,則將組織塊放人三角燒瓶內加入10-30mL0.125%胰蛋白酶,37℃磁力攪拌消化20多min。然後加人少量血清終止消化。用幾層無菌紗布過濾。取過濾液,800r/min離心5-10min收集細胞。棄上清,加入帶有雙抗的培養基,放入培養瓶中培養。
5.若進行組織塊培養,則不做步驟4,加入幾滴血清於組織塊中,再用彎頭吸管將組織塊懸液吸起。在一小培養瓶中逐個鋪展開,注意將瓶底塗抹均勻。將瓶子翻轉倒置後在37℃培養箱內放置2-3h。待組織塊微干與瓶壁粘牢後再輕輕將瓶子翻轉過來,從邊角加入4-5mL培養基,使細胞接觸到培養基,放培養箱內繼續進行培養。
操作要領
混勻操作要領
(1)火焰消毒吸管,用Hanks液冷卻和濕潤管內壁(這是因為剛分離的組織細胞易粘在管壁上)
(2)吸管頭插入管底
(3)用吸管反覆輕輕吹打組織塊
器械的使用
(1)用工作台消毒鑷子取浸泡在酒精中消毒的器械。
(2)器械置無菌干紗布內嚓一下。迅速通過火焰,冷卻後使用。
(3)用過的器械置另一加蓋的器皿中再消毒。
(4)器械按浸泡消毒的順序使用。
(5)各套再消毒器械不可混用。
除去組織塊多餘水分
用吸管將組織塊推向青黴素瓶一角,然後將有組織塊的瓶面翻向上方,吸去流向對側的多餘水分。
注意:多餘水分若不除去,會使組織塊剪切不細,消化後的細胞懸液清亮(細胞數少),並可見消化液中消化液中有線狀或絮狀物漂浮。
細胞計數
(1)用吸管混勻待計數的細胞懸液。
(2)將一小滴細胞懸液從蓋玻片與載玻片交界部位滴入細胞計數池中。
(3)沉降1分鐘,低倍鏡下計數血球計數板四大中格的結構完整的細胞,小細胞團計數為1。
(4)計數時,如果細胞壓在格上,則數上不數下,數左不數右。然後按下式計算出每毫升懸液中的細胞數。
(四大中格細胞數/4)*10000=細胞數/毫升
注意事項
一、注意污染
1、嚴格進行動物皮膚消毒,使用三套器械取材。新生動物皮膚先用2%碘酒液消毒,成年鼠先用3%~5%碘酒液消毒後用75%酒精消毒。
2、嚴格進行無菌操作,防止細菌、黴菌、支原體污染,避免化學物質污染。
3、吸取液體前,瓶口和吸管硬行火焰消毒;吸取液體時,避免倆這碰撞。
4、離心管入台前,管口、管壁應消毒。
5、實驗者離開超淨台時,要隨時用肘部關閉工作窗。
6、使用過的器械用酒精棉球嚓去血污後,移入另一個器皿中繼續消毒,在浸泡器械時剪刀口要叉開放,鑷子彎頭要向下放,並加蓋消毒。二、器材使用時既要注意用火焰消毒,又要防止燙傷、燙死細胞。經火焰消毒後的吸管一定要用Hanks液冷卻。
三、超淨台內溫度、濕度較大,在夏天工作時台內散熱更慢,因此進行細胞懸液混勻、接種時,離火焰要稍微遠些。
| 關於「原代培養」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |