醫學免疫學/補體系統的激活
| 醫學電子書 >> 《醫學免疫學》 >> 補體系統 >> 補體系統的激活 |
| 醫學免疫學 |
|
|
|
補體系統各成分通常多以非活性狀態存在於血漿之中,當其被激活物質活化之後,才表現出各種生物學活性。補體系統的激活可以從C1開始;也可以越過C1、C2、C4,從C3開始。前一種激活途徑稱為經典途徑(classical pathway)或替代途徑。「經典」,「傳統」只是意味著,人們早年從抗原體複合物激活補體的過程來研究補體激活的機制時,發現補體系統是從C1開始激活的連鎖反應。從種系發生角度而言,旁路途徑是更為古老的、原始的激活途徑。從同一個體而言,在尚未形成獲得性免疫,即未產生抗體之前,經旁路途徑激活補體,即可直接作用於入侵的微生物等異物,作為非特異性免疫而發揮效應。由於對旁路途徑的認識,遠遠晚在經典之後,加上人們先入為主觀念,造成了命名的不合理。
目錄 |
一、經典激活途徑
參與補體經典激活途徑的成分包括C1~C9。按其在激活過程中的作用,人為地分成三組,即識別單位(Clq、Clr、Cls)、活化單位(C4、C2、C3)和膜攻擊單位(C5~C9),分別在激活的不同階段即識別階段、活化階段和膜功擊階段中發揮作用。
(一)識別階段
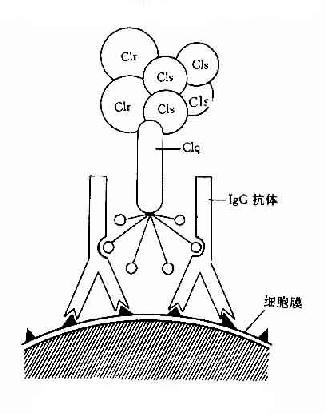
圖3-1 CIq示意圖
C1與抗原抗體複合物中免疫球蛋的補體結合點相結合至C1酯酶形成的階段。
C1是由三個單位Clq、Clr和Cls依賴Ca+結合成的牢固的非活性大分子。
Clq:Clq分子有6個能與免疫球蛋白分子上的補體結合點相結合的部位。當兩個以上的結合部位與免疫球蛋白分子結合時,即Clq橋聯免疫球蛋白之後,才能激活後續的補體各成分(圖3-1)IgG為單體,只有當其與抗原結合時,才能使兩個以上的IgG分子相互靠攏,提供兩個以上相鄰的補體結合點不能與Clq接觸,只有當IgM與抗原結合,發生構型改變,暴露出補體結合部位之後,才能與Clq結合。一個分子的IgM激活補體的能力大於IgG。Clq與補體結合點橋聯後,其構型發生改變,導致Clr和Cls的相繼活化。
Clr:Clr在C1大分子中起著連接Clq和Cls的作用。Clq啟動後可引起Clr構型的改變,在活性的Clr,後者可使Cls活化。
Cls:Clr使Cls的肽鏈裂解,其中一個片段Cls具有酯酶活化,即CI的活性。此酶活性可被C1INH滅活。
在經典途徑中,一旦形成Cls,即完成識別階段,並進入活化階段。
(二)活化階段
CI作用於後續的補體成分,至形成C3轉化酶(C42)和C5轉化酶(C423)的階段。
C4:C4是CI的底物。在Mg2+存在下,CI使C4裂解為C4a和C4b兩個片段,並使被結合的C4b迅速失去結合能力。CI與C4反應之後能更好地顯露出CI作用於C2的酶活性部位。
C2:C2雖然也是CI的底物,但CI先在C4作用之後明顯增強了與C2的相互作用。C2在Mg2+存在下被CI裂解為兩個片段C2a和C2b。當C4b與C2a結合成C4b2b(簡寫成C42)即為經典途徑的C3轉化酶。
C3:C3被C3轉化酶裂解在C3a和C3b兩個片段,分子內部的疏酯基(-S-CO-)外露,成為不穩定的結合部位。硫酯基經加水分解,成為-SH和-COOH也可與細菌或細胞表面的-NH2和-OH反應而共價結合。因此,C3b通過不穩定的結合部位,結合到抗原抗體複合物上或結合到C42激活C3所在部位附近的微生物、高分子物質及細胞膜上。這點,對於介導調理作用和免疫粘附作用具有重要意義。C3b的另一端是個穩定的結合部位。C3b通過此部位與具有C3b受體的細胞相結合(圖3-2)。C3b可被I因子滅活。C3a留在液相中,具有過敏毒素活性,可被羥肽酶B滅活。
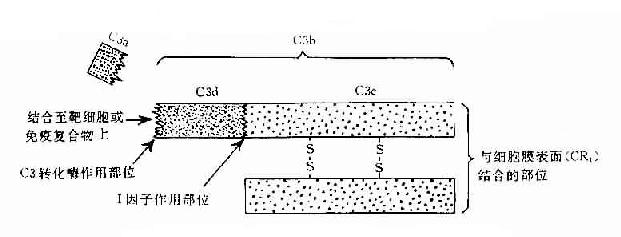
圖3-2 C3分子及其裂解產物生物活性示意圖
C3b與C42相結合產生的C423(C4b2b3b)為經典途徑的C5轉化酶。至此完成活化階段。
(三)膜攻擊階段
C5轉化酶裂解C5後,繼而作用於後續的其他補體成分,最終導致細胞受損、細胞裂解的階段。
C5:C5轉化酶裂解C5產生出C5a和C5b兩個片段。C5a游離於液相中,具有過敏毒素活性和趨化活性。C5b可吸附於鄰近的細胞表面,但其活性極不穩定,易於衰變成C5bi。
C6~C9:C5b雖不穩定,當其與C6結合成C56複合物則較為穩定,但此C5b6並無活性。C5b6與C7結合成三分子的複合物C5b67時,較穩定,不易從細胞膜上解離。
C5b67即可吸附於已致敏的細胞膜上,也可吸附在鄰近的,未經致敏的細胞膜上(即未結合有抗體的細胞膜上)。C5b67是使細胞膜受損傷的一個關鍵組分。它與細胞膜結合後,即插入膜的磷脂雙層結構中。
若C5b67未與適當的細胞膜結合,則其中的C5b仍可衰變,失去與細胞膜結合和裂解細胞的活性。
C5b67雖無酶活性,但其分子排列方式有利於吸附C8形成C5678。其中C8是C9的結合部位,因此繼續形成C5~9,即補體的膜攻擊單位,可使細胞膜穿孔受損。
目前已經證明,不C5b、C6、C7結合到細胞膜下是細胞膜仍完整無損;只有在吸附C8之後才出現輕微的損傷,細胞內容物開始滲漏。在結合C9以後才加速細胞膜的損傷過程,因而認為C9是C8的促進因子。(圖3-3)。
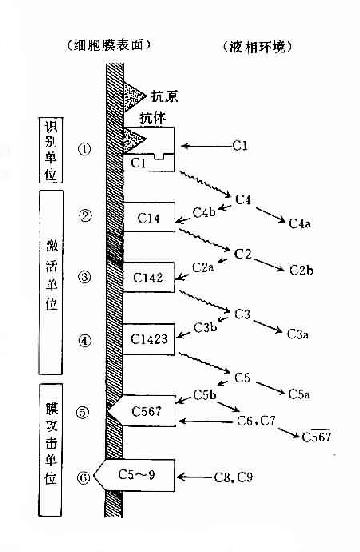
圖3-3 經典途徑的激活
二、旁路激活途徑
旁路激活途徑與經典激活途徑不同之處在於激活是越過了C1、C4、C2三種成分,直接激活C3繼而完成C5至C9各成分的連鎖反應,還在於激活物質並非抗原抗體複合物而是細菌的細胞壁成分—脂多糖,以及多糖、肽聚糖、磷壁酸和凝聚的IgA和IgG4等物質。旁路激活途徑在細菌性感染早期,尚未產生特異性抗體時,即可發揮重要的抗感染作用。
(一)生理情況下的準備階段
在正常生理情況下,C3與B因子、D因子等相互作用,可產生極少量的C3B和C3bBb(旁路途徑的C3轉化酶),但迅速受H因子和I因子的作用,不再能激活C3和後續的補體成分(圖3-4,左)。只有當H因子和I因子的作用被阻擋之際,旁路途徑方得以激活(圖3-4,右)。
C3:血漿中的C3可自然地、緩慢地裂解,持續產生少量的C3b,釋入液相中的C3b迅速被I因子滅活。
B因子:液相中緩慢產生的C3b在Mg2+存在下,可與B因子結合形成C3Bb。
D因子:體液中同時存在著無活性的D因子和有活性的D因子(B因子轉化酶)。D因子作用於C3bB,可使此複合物中的B因子裂解,形成C3bBb和Ba游離於液相中。C3bBb可使C3裂解為C3a和C3b,但烊際上此酶效率不高亦不穩定,H因子可置換C3bBb複合物中的Bb,使C3b與Bb解離,解離或游離的C3b立即被I因子滅活。因此,在無激活物質存在的生理情況下,C3bBb保持在極低的水平,不能大量裂解C3,也不能激活後續補體成分。但是這種C3的低速度裂解和低濃度C3bBb的形成,具有重大意義。可比喻為處於「箭在弦上,一觸即發」的狀態。
(二)旁路途徑的激活
旁路途徑的激活在於激活物質(例如細菌脂多糖、肽聚糖;病素感染細胞、腫瘤細胞,痢疾阿米巴原蟲等)的出現。目前認為,激活物質的存在為C3b或C3bBb提供不易受H因子置換Bb,不受Ⅰ因子滅活C3b的一種保護性微環境,使旁路激活途徑從和緩進行的準備階段過渡到正式激活的階段(圖3-4)。
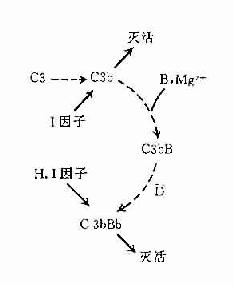
.
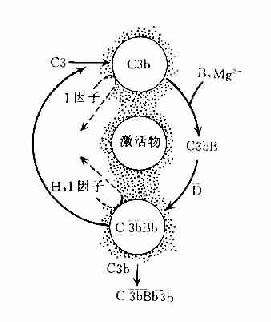
圖3-4 旁路途徑的激活
左:在正常後理情況下,可產生出少量C3bBb,但迅即被激活。
右:在激活物存在下,C3b不易被I因子滅活,C3bBb中的Bb不易被H因子置換,使激活過程得以進行。
P因子:P因子舊稱備解素(properdin)。正常血漿中也有可以互相轉換的兩種P因子,P和P。C3bBb的半衰期甚短,當其與P因子結合成為C3bBbP時,半衰期可延長。這樣可以獲得更為穩定的、活性更強的C3轉化酶。
C3bBb3b:C3bBb與其裂解C3所產生的C3b可進一步形成多分子複合物C3bBb3b。C3bBb3b像經典途徑中的C5轉化酶C423一樣,也可使C5裂解成C5a和C5b。後續的C6~C9各成分與其相互作用的情況與經典途經相同。
(三)激活效應的擴大
C3在兩條激活途徑中都佔據著重要的地位。C4是血清中含量最多的補體成分,這也正是適應其作用之所需。不論在經典途徑還是在旁路途徑,當C3被激活物質激活時,其裂解產物C3b又可在B因子和D因子的參與作用下合成新的C3bBb。後者又進一步使C3裂解。由於血漿中有豐富的C3,又有足夠的B因子和Mg2+,因此這一過程一旦被觸發。就可能激活的產生顯著的擴大效應。有人稱此為依賴C3Bb的正反饋途徑,或稱C3b的正反饋途徑(圖3-5)。
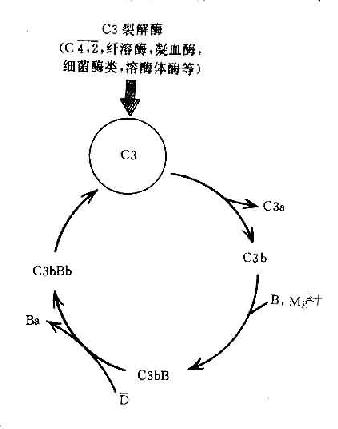
圖3-5 C3b的正反饋途徑
三、兩條激活途徑的比較
補體的兩條激活途徑有共同之處,又有各自的特點。在補體激活過程中,兩條途徑都是補體各成分的連鎖反應,許多成分在相繼活化後被裂解成一大一小兩個片段;不同的片段或片段的複合物可在靶細胞表面向前移動,如C42,C423,C5b,C567,雖亦可原始的激活部位就地形成複合物,但仍以移動為主,在激活過程中,補體成分和(或)其裂解產物組成更大的複合物,同時又都在擴大其激活效應,這一過程可形象地比喻為「滾雪球」。
兩條途徑的不同之處參見表3-4及圖3-6。
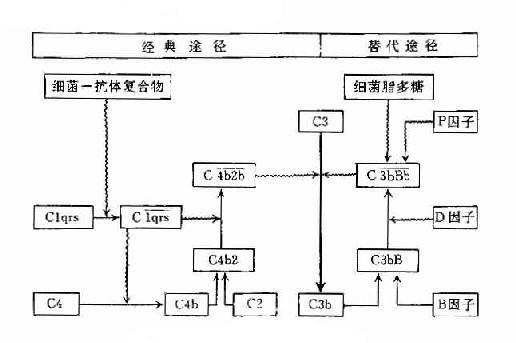
圖3-6 兩條激活途徑的比較
表3-4 兩條激活途徑的主要不同點
| 比較項目 | 經典活途徑 | 旁路激活途徑 |
| 激活物質 | 抗原與抗體(IgM、IgG3、IgG1、IgG2)形成的複合物 | 細胞脂多糖、凝聚的IgG、IgA等 |
| 參與的補體成分 | C1~C9 | C3,C5~C9,B因子,D因子,P因子等 |
| 所需離子 | Ca2+,Mg2+ | Mg2+ |
| C3轉化酶 | C42(C4b2b) | C3bBb |
| C5轉化酶 | C423(C4b2b3b) | C3bBb3b |
| 作用 | 參與特異性體液體免疫的效應階段 | 參與非特異性免疫,在感染早期即發揮作用 |
四、補體激活過程的調節
機體通過一系列的複雜的因素,調節補體系統的激活過程,使之反應適度。例如經C3b的正反饋途徑即可擴大補體的生物學效應。但補體系統若過度激活,不僅無益地消耗大量補體成分,使機體抗感染能力下降;而且在激活過程中產生的大量行物活性物質,會使機體發生劇烈的炎症反應或造成組織損傷,引起病理過程。這種過度激活及其所造成的不良後果,可通過調控機制而避免。這種調控機制包括補體系統中某些成分的裂解產物易於自行衰變以及多種滅活因子和抑制物的調節作用。
(一)自行衰變調節
某些補體成分的裂解產物極不穩定,易於自行衰變,成為補體激活過程中的一種自控機制。例如C42複合物中的C2b自行衰變即可使C42不再能持續激活C3,從而限制了後續補體成分的連鎖反應。C5b亦易於自行衰變,影響到C6~C9與細胞膜的結合。
(二)體液中滅物質的調節
血清中含有多種補體成分的抑制或滅活特定的補體成分。
CI抑制物:CI抑制物(Ci inhibitor,CIINH)可與CI不可逆地結合,使後者失去酯酶活性,不再裂解C4和C2,即不再形成C42(C3轉化酶),從而阻斷或削弱後續補體成分的反應。遺傳性CIINH缺陷的患者,可發生多以面部為中心的皮下血管性水腫,並常以消化道或呼吸道粘膜的局限性血管性水腫為特徵。其發生機制是CI未被抑制,與C4、C2作用後產生的C2a(舊稱C2b的小片段)為補體激肽,或增強血管通透性,因而發生血管性腫。
CIINH缺陷時,C4、C2接連不斷地被活化,故體內C4、C2水平下降;因其不能在固相上形成有效的C42(C3轉化酶),所以C3及其後續成分不被活化。因此本病不像C3~C8缺陷那樣容易發生感染。
大部分CIINH缺陷病人與遺傳有關,另有約15%的病人無遺傳史,其CIINH雖有抗原性但無活性(部分可產生正常CIINH,並非完全缺陷)。前者稱為I型血管性水腫,後者稱為Ⅱ型血管性水腫(Alsenz等,1987)。
血管性水腫可用提純的CIINH治療,據稱有效,亦可給以男性激素製劑以促進肝合成CIINH,預防水腫的發生。
C4結合蛋白:C4結合蛋白(C4 binding protein, C4bp)能競爭性地抑制C4b與C2b結合,因此能抑制C42(C3轉化酶)的形成。
I因子:I因子又稱C3b滅活因子(C3b inactivator, C3b INA)能裂解C3b,使其成為無活性的C3bi,因而使C42及C3bBb失去與C3b結合形成C5轉化酶的機會。
當遺傳性I因子缺陷時,C3b不被滅活而在血中持續存在,可對旁路途徑呈正反饋作用,陸續使C3裂解併產生出更多的C3b。因此血中C3及B因子的含量因消耗而降低。當發生細菌性感染時,因補體系統主要成分C3和B因子嚴重缺乏,削弱了抗感染作用,可因條件致病菌惹發嚴重的甚至致命性後果。
H因子:H因子雖能滅活C3b,但不能使C3bBb中的C3b滅活。H因子(factor H)不僅能促進I因子滅活C3b的速度,更能競爭性地抑制B因子與C3b的結合,還能使C3b從C3bBb中致換出來,從而加速C3bBb的滅活。由此可見,I因子和H因子在旁路途徑中,確實起到重要的調節作用。
S蛋白:S蛋白(Sprotein)能干擾C5b67與細胞膜的結合。C5b67雖能與C8、C9結合,但它若不結合到細胞膜(包括靶細胞的鄰近的其他細胞)上,就不會使細胞裂解。
C8結合蛋白:C8結合蛋白(C8binding protein,C8bp)又稱為同源性限制因子(homologousrestriction factor,HRF)。C56與C7結合形成C567即可插入細胞膜的磷脂雙層結構之中,但兩者結合之前,可在體液中自由流動。因此,C567結合的細胞膜不限於引起補體激活的異物細胞表面,也有機會結合在自身的細胞上,再與後續成分形成C5~9大分子複合物,會使細胞膜穿孔受損。這樣會使補體激活部位鄰近的自身細胞也被殃及。
C8bp可阻止C5678中的C8與C9的結合,從而避危及自身細胞膜的損傷作用。C8分子與C8bp之間的結合有種屬特異性,即C5678中的C8與同種C8bp反應;但與異性種動物的C8不反應,所以又稱為HRF。據稱C8bp也能抑制NK細胞和Tc細胞的殺傷作用,值得注意。
| 關於「醫學免疫學/補體系統的激活」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |