醫學免疫學/免疫球蛋白分子的超家族
| 醫學電子書 >> 《醫學免疫學》 >> 免疫球蛋白分子 >> 免疫球蛋白分子的結構與功能 >> 免疫球蛋白分子的超家族 |
| 醫學免疫學 |
|
|
|
應用DNA序列分析和X晶體衍射分析等研究表明,許多細胞膜表面和機體某些蛋白質分子,其多肽鏈摺疊方式與Ig摺疊相似,在DNA水平和胺基酸序列上與IgV區或C區有較高的同源性,它們可能從同一原始祖先基因(primodial ancestral gene)經複製和突變衍生而來。編碼這些多肽鏈的基因稱為免疫球蛋白基因超家族(immunoglobulin gene superfamily),這一基因超家族所編碼的產物稱為免疫球蛋白超家族(immunogloblin superfamily,IGSF)。
(一)免疫球蛋白超家族的組成
由於細胞表面標記、單株抗體以及基因工程研究的進展,近年來發現屬於IGSF的成員已達近百種,主要包括T細胞、B細胞抗原識別受體和信號傳導分子,MHC及相關分子,Ig受體,某些細胞因子受體,神經系統功能相關分子,以及部分白細胞分化抗原(CD)(表2-2)。
表2-2 免疫球蛋白超家族的組成(成員舉例)
| 主要功能 | 成員 |
| 抗原識別受體和信號傳導分子 | IgH鏈:μ、γ、δ、ε和α鏈 IgL鏈:κ和λ鏈 SmIg複合物成分:MG-1(Ig-α,CD79a)、B29(Ig-β,CD79b) TCR:α、β、γ和δ鏈 CD3:γ、δ和ε鏈 |
| MHC及其相關分子 | MHCⅠ類抗原:α鏈、β2M MHCⅡ類抗原:α、β鏈 β2M相關分子:CD1、Qa、TL |
| 免疫球蛋白受體 | PolyIgR(pIgR) IgG Fc段受體:FcγRⅠ(CD64)、FcγRⅡ、FcγRⅢ(CD16) Ige Fc段受體:FcεRIα鏈 IgE Fc段受體:FcαR |
| 細胞因子受體 | IL-1R(CDw121a),IL-6R(CD126),M-CSFR(CD115),G-CSFR、SCFR(CD117),PDGFR |
| 白細胞分化抗原 | CD2,LFA-3(CD58),ICAM-1(CD54),ICAM-2(CD102)、ICAM-3(CD50),CD4,CD8α、β鏈,CD28,B7/BB1(CD80),CD7,CD22,CD33,CD48,CEA(CD66e),Thy-1(CDw90),PECAM-1(CD31),VCAM-1(CD106) |
(二)免疫球蛋白超家族的特點
1.IGSF的結構特點 IGSF的成員均含有1~7個Ig樣功能區,第個Ig樣功能區約含100(70~110)個胺基酸殘基,功能區的二級結構是由3~5個股反平行β摺疊股各自形成兩個平行β片層的平面(anti-paralle β-pleated sheet),每個反平行β摺疊股由5~10個胺基酸基組成,β片層內側的疏水性胺基酸起到穩定Ig摺疊的作用,大多數功能區內有一個二硫鍵,垂直連接兩個β片層,形成二硫鍵的兩個半胱氨酸間有55~75個胺基酸殘基,使之成為一個球形結構,肽鏈的這種摺疊方式稱為免疫球蛋摺疊(Ig fold)。
根據IGSF功能區中Ig摺疊方式、兩個半胱氨酸之間胺基酸殘基的數目以及與IgV區或C區同源性的程度,IGSF功能區可分為V組、C1組和C2組。
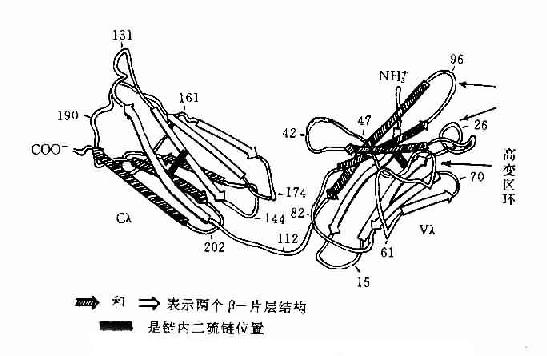
圖2-11 人Ig輕鏈(λ)多肽摺疊示意圖
(1)V組:V組功能區的兩個半胱氨酸之間含65~75個胺基酸殘基,有9個反平行β摺疊股,如IgH鏈和L鏈V區,TCRα、β、γ、δ鏈V區,CD4v區,CD8α、β鏈V區,Thy-1,pIgR和分泌成分(SC)N端四個功能區,CEAN端第一個功能區,PDGFR靠近胞膜的功能區等。
(2)C1組:又稱C組。C1組功能區二個半胱氨酸之間約含50~60個胺基酸殘基,有7個β摺疊股,如IgH鏈和L鏈C區(γ、δ和α鏈的CH1~CH3或μ和ε鏈的CH1~CH4),TCRα、β、γ、δ鏈C區,MHc Ⅰ類分子重鏈α3功能區,β2M,MHCⅡ類分子α2和β2功能區,CD1、Qa和TL靠近胞膜功能區等。
(3)C2組:又稱H組。C2組功能區的胺基酸排列的順序類似V組,但形成二硫鍵的兩個半胱氨酸之間所含胺基酸殘基數約為50~60,有7個β摺疊股,這種結構介於V組和C1組之間,如CD3γ、δ和ε鏈,CD2和LFA-3(CD58),pIgR靠近胞膜功能區,FcγRⅠ、FcγRⅡ、FcγRⅢ、FcεRⅠα鏈、FcαR,ICAM-1,CEA第2至7個功能區,IL-6R、M-CSFR、G-CSFR、SCFR。PDGFR第1至4功能區,以及N-CAM、CD22、CD48分子等。
2.IGSF功能特點 IGSF的功能是以識別為基礎,因此又稱為識別球蛋白超家族(cognoglobulinsuperfamily)。IGSF很可能起源於原始的具有粘功能的基因,通過複製和突變衍生形成了識別抗原、細胞因子受體、IgFc段受體、細胞間粘附分子以及病毒受體等不同的功能區。IGSF識別的基本方式有以下幾種。
(1)IGSF和IGSF相互識別:①同嗜性相互作用(heterophilicinteraction)如相同神經細胞粘附分子(N-CAM)之間的相互識別,血小板內皮細胞粘附分子-1(PECAM-1,CD31)的相互識別;②異嗜性相互作用( heterophilic interaction),如CD2與LFA-3,CD4與MHCⅡ類分子的單態部分(α2和β2),CD8與MHCⅠ類分子的單態部分(α3),poly IgR與多聚Ig,FcγRⅠ(CD64)、FcγRⅡ(CD32)、FcγRⅢ(CD16)與IgG Fc 段,FcγRⅠ與Ige Fc段,FcαR(CD89)與IgA Fc段,CD28與B7/BB1(CD80)等之間的相互識別。
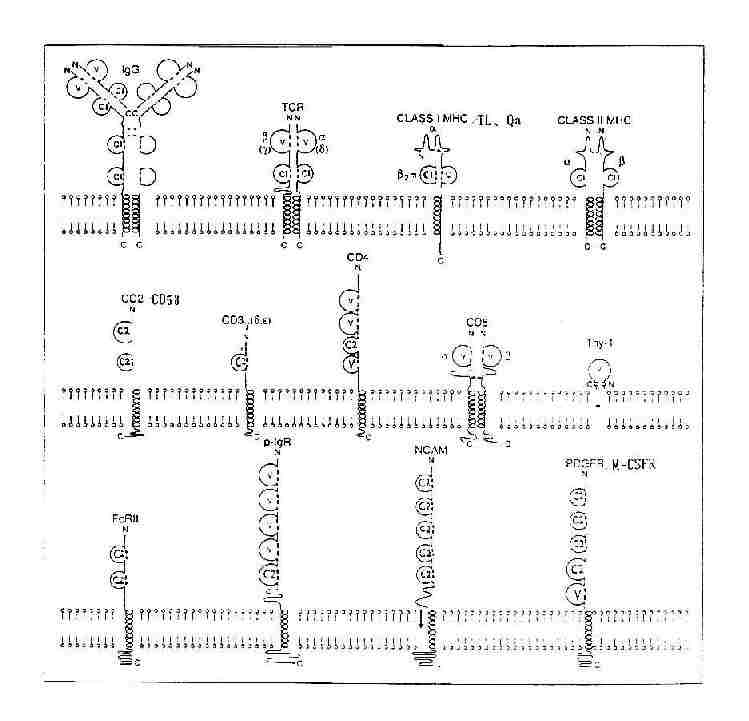
圖2-12 免疫球蛋白超家族V組、C1組和C2組結構模式圖
(2)IGSF和結合素(integrin)相互識別:如ICAM-1(CD54)、ICAM-2(CD102)與LFA-1(CD11a/CD18),VCAM-1(CD106)與VLA-4(CD49d/CD29)之間的相互作用。
(3)IGSF和其它分子的相互識別:包括TCR識別MHCⅠ類或Ⅱ類分子與抗原複合物,細胞因子受體識細胞因子等。
| 關於「醫學免疫學/免疫球蛋白分子的超家族」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |