醫用化學/高分子化合物溶液
| 醫學電子書 >> 《醫用化學》 >> 膠體溶液 >> 高分子化合物溶液 |
| 醫用化學 |
|
|
一、高分子化合物的概念
在自然界中,存在著大量高分子化合物。隨著科學技術的發展,人們又合成了大量的高分子化合物。它們的共同特點是都具有很大的相對分子質量。如生物體中的蛋白質、核酸、糖原、澱粉、纖維等都是高分子化合物。它們是由許多重複的原子團或分子殘基所組成,這些較小的原子團或分子殘基叫做單體。如澱粉分子是由成千上萬個葡萄糖分子殘基按一定方式聯結而成的。天然橡膠分子是由許多異戊二烯(CH2=C(CH3)-CH=CH2)的單體聯結而成的大分子。
高分子化合物是大分子,其粒子的形狀是複雜的。不同高分子化合物,在溶液中分子的形狀往往也有很大的差異。例如,γ-球蛋白的分子是球形分子,脫氧核糖核酸分子是線形分子。線形分子在不同條件下形狀有時也不一樣,有的是比較伸展的線條形,有的則是捲曲的無規則線團。由於分子形狀不同,它們在運動中的相互干擾作用也不一樣。球形分子互相干擾少,而線形分子則互相干擾大,因此線形分子的粘度就大。
高分子化合物粒子具有許多親溶劑基團,質點表面結合著一層溶劑。溶劑化後的粒子在溶液中成為一個運動單體,降低了運動速度,影響了溶液的粘度。
當高分子化合物為電解質時,粒子帶有電荷。例如蛋白質類高分子化合物,由於含有酸性基團(-COOH)和鹼性基團(-NH2),在水溶液中,因溶液PH值的差異,蛋白質大分子可以帶正電荷或負電荷。
大分子的這些特性,往往影響到高分子化合物溶液的性質。
二、高分子化合物溶液的性質
高分子化合物溶液中,溶質和溶劑有較強的親和力,兩者之間有沒有界面存在,屬均相分散系。由於在高分子溶液中,分散質體子已進入膠體範圍(1-100nm),因此,高分子化合物溶液也被列入膠體體系。它具有膠體體系的某些性質,如擴散速度小,分散質體子不能透過半透膜等,但同時也具有自己的特徵。
(一)穩定性
高分子化合物溶液屬均相分散系,可長期放置而不沉澱。在穩定性方面它與真溶液相似。
另外,由於高分子化合物具有許多親水基團(如-OH,-COOH,-NH2等),當其溶解在水中時,其親水基團與水分子結合,在高分子化合物表面形成了一層水化膜,使分散質體子不易靠近,增加了體系的穩定性。
(二)粘度
液體的一部分流過其他一部分所受到的阻力叫粘度。高分子化合物溶液的粘度比一般溶液或溶膠大得多,高分子化合物溶液的高粘度與它的特殊結構有關。
高分子化合物常形成線形、枝狀或網狀結構,這種伸展著的大分子在溶劑中的行動困難,枝狀、網狀結構牽制溶劑,使部分液體失去流動性,自由液體量減少,故表現為高粘度。由於粘度與粒子的大小、形狀及溶劑化程度直接相關,所以測定蛋白質溶液的粘度就能推知蛋白質分子的形狀和大小。
(三)鹽析
鹽析作用在高分子化合物溶液中,加入足夠量的中性鹽時,可使高分子化合物從溶液中析出,這就是鹽析作用。使一升溶液出現鹽析現象所需中性鹽的最小量稱鹽析濃度,單位為mol.L-1。鹽析濃度一般都比較大,如血漿中各種蛋白質鹽析所需的鹽一般不少於1.3-2.5mol.L-1。
鹽析效應的特點是,同價同符號的不同離子,對鹽析效應的能力不一樣。
已發現各種鹽的鹽析能力,其陰離子的能力有如下次序:
1/2SO42->OAc->CL->NO2->Br->I->CNS-
其陽離子則有如下次序:
鹽析作用的實質,主要是高分子化合物與溶劑(水)間的相互作用被破壞,鹽的加入使高分子化合物分子脫溶劑化。鹽的加入還使一部分溶劑(水)與它們形成溶劑(水)化離子,致使這部分溶劑(水)失去溶解高分子化合物的性能。溶劑(水)被電解質奪去,高分子化合物沉澱析出。所以鹽類的水化作用越強,其鹽析作用也越強。上述離子鹽析能力順序,實質上反映了離子水化程度大小的次序。
分段鹽析鹽析時,相對分子質量大的蛋白質比相對分子質量小的蛋白質更容易沉澱。利用這一原理可以用不同濃度的鹽溶液使蛋白質分段析出加以分離。例如,(NH4)2SO4使血清中球蛋白鹽析的濃度是2.0mol.L-1,清蛋白鹽析濃度是3-35mol.L-1。在血清中加(NH4)2SO4達一定量,則球蛋白先析出,濾去球蛋白,再加(NH4)2SO4則可使清蛋白析出,這個過程叫分段鹽析。
(四)高分子化合物溶液的保護作用
在溶膠中加入適量高分子化合物溶液,可以顯著的增加溶膠的穩定性,這種現象叫保護作用。在製備銀溶膠的過程中,加入蛋白質所得的膠體銀(稱為蛋白銀),較普通銀溶膠穩定。將所得蛋白銀蒸干後能重新溶於水。蛋白銀比普通銀溶膠濃度更高,銀粒更細,它含膠體銀8.5%-20%,是極強的防腐劑。當保護蛋白質減少時,這些微溶性鹽就要沉澱,因而形成結石。
一般認為高分子化合物保護作用的機理是,高分子化合物的大分子為溶膠膠粒所吸附,並在膠粒表面形成保護膜,因而大大削弱了膠粒聚結的可能性。
(五)膜平衡
當用半透膜將高分子電解質(R-Na+)溶液和低分子電解質(Na+CL-)溶液隔開,其中高分子離子(R-)不能透過半透膜,其它低分子離子(Na+、CL-等)都能自由透過半透膜,結果會有一定量低分子電解質離子透過膜進入高分子電解質溶液中,當小離子透過速度相等,並保持膜兩側電中性時,即達平衡狀態,這時所發生的平衡現象叫膜平衡或董南(Donnan)平衡。
設高分子電解質溶液的濃度為c1,NaCL溶液的濃度為c2,設膜內外的體積相等。
因為膜內沒有CL-,擴散結果使 一部分CL-通過半透膜進入膜內,設達到平衡時進入膜內的CL-濃度為x,根據整個溶液保持電中性原則,就必須有相等數目(x)的Na+同CL-一道進入膜內。

在平衡時,Na+ 和CL-進出膜的速度應相等,則:
ν進=k進[Na]外.[Cl]外
ν出=k出[Na]內.[Cl]內
因 ν進=ν出,且k進=k出
故 [Na+]內.[Cl-]內=[Na+]外.[Cl-]外
將相應濃度代入上式:x(c1+x)=(c2-x)2
整理後,得:
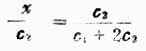
左邊的x/c2說明膜外電解質進入膜內的百分率,稱為擴散分數。
當c2c1,即外側電解質過量時(c1可略去不計),則x/c2≈1/2說明電解質將平均分配在膜內外兩側。當 c2c1,即只有微量電解質時,x/c2≈0
(c2幾乎等於零),說明電解質幾乎留在外側。
由此可見,在膜的一邊存在的不能透過膜的高分子離子,對膜兩側的電解質濃度分布有很大的影響。當膜內高分子離子濃度很大時,電解質在膜兩側濃度分布的差值也很大。這時就表現為膜對Na++CL-好象完全不能透過,從而糾正了單純從膜孔大小來解釋生理上細胞膜對離子有選擇透過性的看法。但是生物體內的活細胞膜的結構比較複雜,活細胞處於不斷代謝過程中,故生物細胞膜是一種動態的體系,其組成、結構和性質也可隨時改變,因此,在研究生理上膜的作用時,不能把它當作一種簡單的半透膜來對待。
| 關於「醫用化學/高分子化合物溶液」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |