醫學免疫學/MHC抗原
| 醫學電子書 >> 《醫學免疫學》 >> 免疫細胞膜分子(一):主要組織兼容性抗原 >> MHC抗原 |
| 醫學免疫學 |
|
|
一、HLA抗原的分子結構
1987年Bjorkman等首先藉助X線晶體衍射技術弄清了HLA-A2分子的立體結構。其後,其它HLA-Ⅰ、Ⅱ類分子結構的研究也取得了進展,從而對這些分子的生物學功能提供了較確切的解釋。
(一)HLA-Ⅰ類分子
所有的HLA-Ⅰ類分子均含有二條分離的多肽鏈,一條是由MHC基因編碼的α鏈或稱重鏈(44kD)。根據對HLA-A2和Aw68分子的晶體結構分析,Ⅰ類分子可分為四個區:(圖5-5):①氨基端胞外多肽結合區:該區由二個相似的各包括90個胺基酸殘基的片段組成,分別稱為α1和α2。該功能區含有與抗原結合的部位。後者呈深槽狀,其大小與形狀適合於已處理的抗原片段,約容納8~10個胺基酸殘基。Ⅰ類分子的多態性殘基也位於該區域。②胞外lg樣區:該區又稱為重鏈的α3片段,包括90個胺基酸殘基,與免疫球蛋白的恆定區具有同源性。Ⅰ類分子與TC細胞表面CD8分子的結合部位即在α3片段。Ⅰ類分子的β鏈又稱β2微球蛋白,也結合於該區。β鏈由第15號染色體的基因編碼,它不插入細胞膜而游離於細胞外。β2微球蛋白與α1、α2、α3片段的相互作用對維持Ⅰ類分子於然構型的穩定性及其分子表達有重要意義。③跨膜區:該區胺基酸殘基形成螺旋狀穿過漿膜的脂質雙層,將類分子錨定在膜上。④胞漿區:該區位於胞漿中,可能與細胞內外信息傳遞有關。
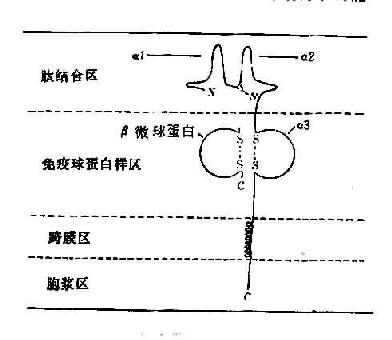
圖5-5 HLA-Ⅰ類分子結構示意圖
(二)HLA-Ⅱ類分子
所有的Ⅱ類分子均由二條以非共價鍵連接的多肽鏈(α、β)組成。二條鏈的基本結構相似,但分別由不同的MHC基因編碼,且均具有多態性。雖然Ⅱ類分子的晶體衍射結構尚未得到,但光譜分析已證明與Ⅰ類分子具有某種相似性。Ⅱ類分子二條多肽鏈也可分為四個區,見(圖10-6):①肽結合區:α鏈與β鏈的胞外部位均可再分為二個各含90個胺基酸殘基的片段,分別稱為α1、α2和β1、β2。肽結合區包括α1和β1片段,該二片段構成肽結合的裂隙(cleft),約可容納14個胺基酸殘基。Ⅱ類分子的多態性殘基主要集中在α1和β1片段,這種多態性決定了多肽結合部位的生化結構,也決定了與肽類結合以及T細胞識別的特異性和親和力。②lg樣區:此區由α2和β2片段組成,兩者均含鏈內二硫鍵,並屬於lg基因超家族。在抗原呈遞過程中,TH細胞的CD4分子與Ⅱ類分子結合的部位即位於該lg樣非多肽態區域。③跨膜區和胞漿區:該二區與Ⅰ類分子α鏈的相應區域結構相似。
二、HLA抗原的組織分布
各類HLA抗原的組織分布不同。Ⅰ類抗原廣泛分布於體內各種有核細胞表面,包括血小板和網織紅細胞。除某些特殊血型者外,成熟的紅細胞一般不表達Ⅰ類抗原。不同的組織細胞表達Ⅰ類抗原的密度各異。外周血白細胞和淋巴結、脾細胞所含Ⅰ類抗原量最多,其次為肝、皮膚、主動脈和肌肉。但神經細胞和成熟的滋養層細胞不表達Ⅰ類抗原。Ⅱ類抗原主要表達在某些免疫細胞表面,如B細胞、單核/巨噬細胞,樹突狀細胞,激活的t 細胞等,內皮細胞和某些組織的上皮細胞也可檢出HLA-Ⅱ抗原。另外,某些組織細胞在病理情況下也可異常表達Ⅱ類抗原。Ⅰ、Ⅱ類抗原主要分布在細胞表面,但也可能現於體液中,血清、尿液、唾液、精液及乳汁中均已檢出可溶性HLA-Ⅰ、Ⅱ類抗原。HLA-Ⅲ類抗原一般指幾種補體成分,它們均分布於血清中。
三、HLA抗原表達的調控
在各類型細胞表面HLA分子表達與否以及表達的密度,可以受不同的因素調節。一般認為,調控HLA分子表達的主要環節是轉錄速率。可能影響HLA分子表達的因素有:①組織細胞的分化階段:HLA分子是造血幹細胞和某些免疫細胞的分化抗原,在細胞分化、成熟的不同階段,各類HLA抗原的表達可有改變。例如HLA-DQ分子是人單核細胞的成熟標記;Ⅱ類抗原僅表達在激活的T細胞表面。②某些疾病狀態:某些傳染性疾病、免疫性疾病、造血系統疾病以及腫瘤均可影響HLA抗原表達。如AIDS病患者單核細胞HLA-Ⅱ類抗原表達明顯減少,某些腫瘤細胞表面HLA-Ⅰ類抗原表達減少。③生物活性物質:某些細胞因子,例如三類干擾素(α、β、γ)以及TNFα、THFβ均可增強不同類型細胞HLA-Ⅰ類抗原表達;具有Ⅱ類抗原誘生能力的細胞因子包括IFNγ、TNFα、IL-6及GM-CSF等。此外,某些激素、某些神經遞質和神經肽也可影響HLA分子表達。
HLA分子在免疫應答與免疫調節中是一類關鍵的分子,故各種因素對HLA分子表達的調控可能是體內免疫調節網路的重要組成部分。同時,受各種調節因子的影響,HLA分子的異常表達也參與某些疾病的發病機制。
| 關於「醫學免疫學/MHC抗原」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |