醫學免疫學/用標記抗體或抗原進行的抗原、抗體反應
| 醫學電子書 >> 《醫學免疫學》 >> 免疫學檢測法 >> 抗原或抗體的檢測 >> 用標記抗體或抗原進行的抗原、抗體反應 |
| 醫學免疫學 |
|
|
|
用熒光素、同位素或酶標記抗體或抗原,用於抗原或抗體檢測是目前廣泛應用的敏感、可靠的方法。上述三種常用的標記物與抗原或抗體化學連接之後不改變後者的免疫特性。本方法可用於定性、定量或定位檢測。
1.免疫熒光技術 免疫熒光技術(immunofluorescencetechni)是用化學方法使熒光素標記的抗體(或抗原)與組織或細胞中的相應抗原(或抗體)結合,進行定性定位檢查抗原或抗體的方法。
(1)直接熒光法:把熒光抗體加到待檢的細胞懸液,細胞塗片或組織切片上進行染色,經抗原抗體反應後,洗去未結合的熒光抗體,將待檢標本在熒光顯微鏡下觀察,有熒光的部位即有相應抗原存在,此法可用於病毒感染細胞、帶某種特異抗原的細胞(如T細胞和B細胞)或病原菌的檢查,也可用於組織中沉著的免疫複合物的檢查。本法的缺點是檢查多種抗原,就需分別製備相應的多種標記抗體。
(2)間接熒光法:可克服直接法需製備多種熒光抗體的複雜操作。將組織或細胞上的抗原直接與相應抗體(不標記熒光)結合,此為第一抗體,再把能與第一抗體特異結合的熒游標記的抗免疫球蛋白抗體加入,此為熒游標記的第二抗體,觀察結果與直接法相同。間接法比直接法敏感性高,如果用於檢查抗原的第一抗體是人或動物的只需製備一種抗人或動物的免疫球蛋白熒光抗體(圖20-5)。
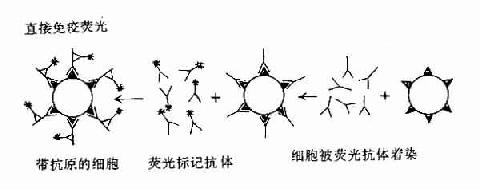
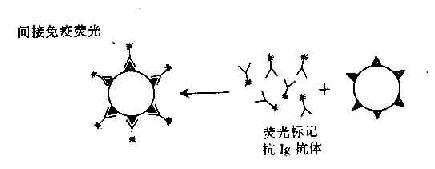
圖20-5 免疫熒光直接法及間接法原理示意圖
免疫熒光技術在傳染病診斷上有廣泛的用途,如在細菌、病毒、螺旋體感染的疾病,檢查抗原或抗體,如查出IgM抗體,可做為近期接觸抗原的標誌,所以使用熒游標記抗IgM可診斷近期感染。除微生物學方面的應用外,還可利用單株抗體鑒定淋巴細胞的亞類。使用流式細胞儀(fluorescene-activated cell sorting,FACS),能自動檢測細胞的大小、熒光強度。針對細胞表面不同抗原,可以使用兩種不同的熒光染料,如用異硫氰熒光素(FITC)發黃綠熒光,用羅丹明(TMRITC)發紅色熒光。由於熒光顏色不同標記兩種不同的抗體,對同一細胞進行雙標記染色。對淋巴細胞亞類鑒定起著巨大推動作用。應用間接熒光法也用於自身免疫病的抗核抗體檢查。
2.放射免疫分析法 放射免疫分析法(radioimmunoassay RIA)應用競爭性結合的原理,應作放射性同素標記抗原(或抗體)與相應抗體(或抗原)結合,通過測定抗原抗體結合物的放射活性判斷結果,本方法可進行超微量分析,敏感性高,可用於測定抗原、抗體、抗原抗體複合物。本法常用的同位素有125Ⅰ和131Ⅰ。
放射免疫分析常用的有液相法和固相法兩種:
(1)液相法:將待檢標本(例如含胰島素抗原)與定時的同位素標記的胰島素(抗原)和定時的抗胰島素抗體混合,經一定作用時間後,分離收集抗原抗體複合物及游離的抗原,測定這兩部分的放射活性,計算結合率。在反應系統中,待檢標本的胰島素抗原與同位素標記的胰島素競爭奪戰 性與胰島素抗體結合。非標記的抗原越多,標記抗原與抗體形成的複合物越少。非標記抗原含量與標記抗原抗體複合物的量呈一定的函數關係。預先用標準的非標記抗原作成標準曲線後,即可查出待檢標本中胰島素的含量(圖20-6)。
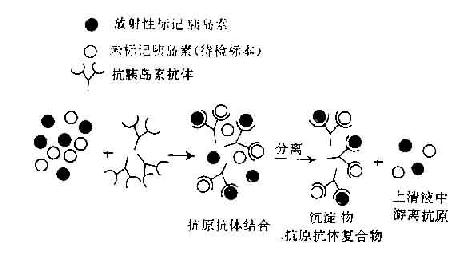
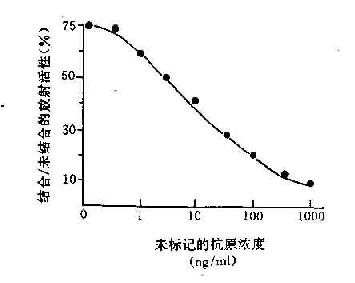
圖20-6 液相放射免疫分析法原理及標準曲線
(2)固相法:將抗原或抗體吸附到固相載體表面,然後加待檢標本,最後加標記抗體。測定固相載體的放射活性,常用的固相載體有溴化氰(CNBr)海豹化的紙片或聚苯乙烯小管(圖20-7)。

圖20-7 固相放射免疫分析法原理
放射免疫分析法應用範圍廣泛,包括多種激素(胰島素、生長激素、甲狀腺素等)維生素、藥物、IgE等。
3.酶聯免疫分析法 酶聯免疫分析法(enzyme immunoassay,EIA)是當前應用最廣泛的免疫檢測方法。本法將抗原抗體反應的特異性與酶對底物高效催化作用結合起來,根據酶作用底物後顯色,以顏色變化判斷試驗結果,可經酶標測定儀作定量分析,敏感度可達ng水平。常用於標記的酶有辣根過氧化物酶(horseradish peroxidase)、鹼性磷酶(alkaline phosphatase)等。它們與抗體結合不影響抗體活性。這些酶具有一定的穩定性,製成酶標抗體可保存較長時間。目前常用的方法有酶標免疫組化法和酶聯免疫吸附法。前者測定細胞表面抗原或組織內的抗原;後者主要測定可溶性抗原或抗體。本法既沒有放射性污染又不需昂貴的測試儀器,所以較放射免疫分析法更易推廣。
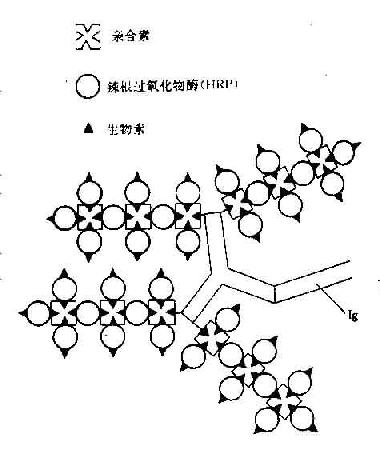
圖20-8 生物素-酶標親合素系統反應示意圖
(1)酶聯免疫吸附試驗(enzymelinked immunosorbent assay,ELISA):是與上述固相RIA相似的原理,將抗原或抗體吸附在固相載體表面。使抗原抗體反應在固相載體表面進行政區。可用間接法、雙抗體夾心法或競爭法測定抗原或抗體。
(2)夾心法(sandwichassay):將已知的特異抗體包裝在固相載體(塑料板凹孔或紙片上),加入待檢標本,標本中的抗原即可與載體上的抗原結合,洗去未結合的材料後加入該抗原的酶標記抗體,洗去未結合的酶標抗體,加底物顯色,用酶免疫檢測儀測量顏色的光密度,可定量測定抗原。
間接法(indirecr ELISA)常用於檢查特異抗體。先將已知特異抗原包被固相載體,加入待檢標本(可能含有相應抗體),再加入酶標抗Ig的抗全(即第二抗體),經加底物顯色後,根據顏色的光密度計算出標本中抗體的含量。
(3)BAS-ELISA:近年來對酶免設分析法的改進是使用生物素-親合素-過氧化物酶複合物作為指示劑,組成一新的生物放大系統進一步提高檢測的敏感度。可用來檢測多種抗原抗體系統如細菌、病毒、腫瘤細胞表面抗原等。一個親合素(avidin)分子可以結合4個生物素分子(biotin)。結合非常穩定。親合素和生物素都可與抗全、酶、熒光素等分子結合,而不影響後者的生物活性。一個抗體分子可偶聯90個生物素分子,通過生物素又可連接多個親合素。因此大提高檢測的敏感度。目前應用生物-酶標親合素系統(biotinavidin system- ELISA,BAS-ELISA),它是通過生物素標記抗體連接免疫反應系統,同時藉助生物素化酶或酶標親合素引入酶與底物反應系統。
表20-1 免疫學測定方法敏感性比較
| 測定方法 | 敏感性(每升) |
| 單向免疫擴散試驗 | <1~2mg |
| 雙向免疫擴散試驗 | <1mg |
| 火箭電泳 | <0.5mg |
| 對流電泳 | <0.1mg |
| 免疫電泳 | <5~10mg |
| 凝集試驗 | 1μg |
| 被動血凝試驗 | 1μg |
| 血凝抑制試驗 | 0.1μg |
| 補體結合試驗 | 0.1μg |
| 放射免疫分析法 | <1pg |
| 酶聯免疫吸附試驗 | <1ng |
| 定量免疫熒光分析 | <1pg |
| 關於「醫學免疫學/用標記抗體或抗原進行的抗原、抗體反應」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |