50S核糖體亞基
| A+醫學百科 >> 50S核糖體亞基 |
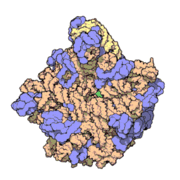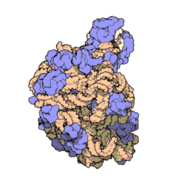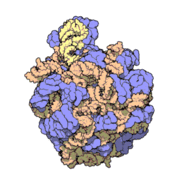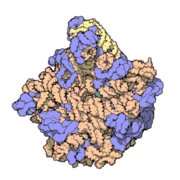
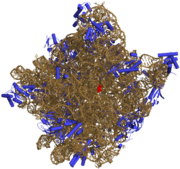
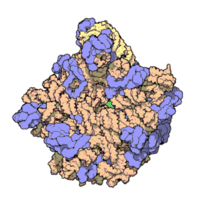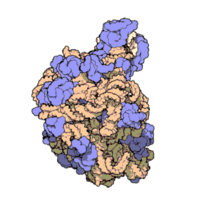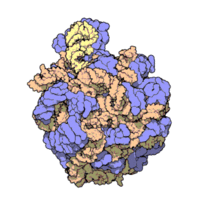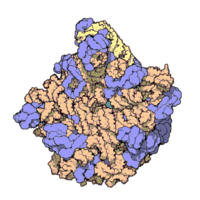
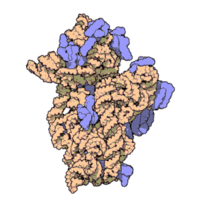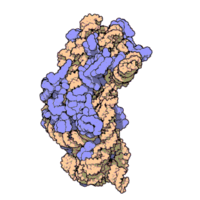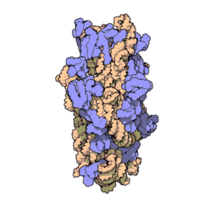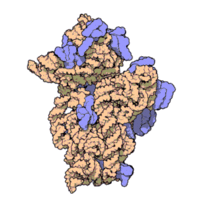
50核糖體亞基是原核細胞內70S核糖體中的較大亞基。該亞基由一條5S rRNA、一條23S rRNA及約34個核糖體蛋白質分子構成,在原核翻譯中負責在tRNA轉運來的胺基酸分子之間形成肽鍵。50S核核糖體亞基是某些抗生素(如氯黴素、氯潔黴素及截短側耳素等)的結合位點,這些抗生素可通過阻斷蛋白質生物合成來殺滅細菌。
目錄 |
組成與結構
50S核糖體亞基是70S核糖體中較大的亞基,由多種核糖體蛋白質及兩種rRNA結合形成。50S核糖體亞基中的rRNA分子不僅具有二級結構,還在二級結構的基礎上建立了更複雜的三級結構。50S核糖體亞基中RNA的三級結構是70S核糖體維持一定形態併產生催化活性的關鍵。
研究人員通過利用電子顯微鏡及X射線晶體學方面的技術獲得了死海鹽盒菌(Haloarcula marismortui)50S核糖體亞基2.4Å解析度的電子密度圖。
50S核糖體亞基的質量約為30S核糖體亞基的兩倍。Steitz實驗室於2000斗製作的50S核糖體亞基結構模型中,包含該實驗室測定的50S核糖體亞基23S rRNA2923個核苷酸中的 2711個、5S rRNA中所有的共122個核苷酸及31個核糖體蛋白質中的27個。
50S核糖體亞基中的23S rRNA在二級結構上可分為六大結構域。其中,結構域Ⅴ的作用對70S核糖體肽醯轉移酶活性的貢獻是最大的。在三級結構的層面上看,50S核糖體亞基中的rRNA是一個獨立的巨大結構域,而30S核糖體亞基中的rRNA則仍具有3個結構域。這個不同導致50S核糖體亞基的撓性比30S核糖體亞基的低,使50S核糖體亞基的結構更穩定,符合其需具備的催化功能對其結構的精確要求。
50S核糖體亞基中的蛋白質大部分都位於該亞基的表面而離活性位點較遠。約17種50S核糖體亞基的蛋白質呈球形,其餘約13種都是完全延展開來的或擁有凸出的延伸區域。50S核糖體亞基的大部分表面區域由核糖體蛋白質覆蓋被認為可以提供自由能以固定該亞基整體結構,使其內部形成穩定的缺少蛋白質的催化區域。研究人員另發現50S核糖體亞基中的某些核糖體蛋白質位於翻譯因子結合位點處,它們的可能被用於與翻譯因子產生相互作用。
功能與作用機制
50S核糖體亞基具有催化肽醯轉移的活性、防止合成中的肽鏈被水解、為G蛋白因子(用於輔助轉錄起始、延伸及終止提供結合位點)並輔助合成後的肽鏈摺疊從而形成蛋白質。
轉肽
研究人員利用誘導契合說解釋了50S核糖體亞基如何催化肽醯轉移反應並防止肽鏈水解[3]:
氨基醯-tRNA進入核糖體A位點,其轉運的胺基酸分子的氨基便進攻在核糖體P位點的肽醯-tRNA羧基中的碳原子,使A位點中的tRNA肽鏈末端通過酯化反應增加一分子胺基酸並使P位點中的tRNA去醯化。
當核糖體A位點被新氨基醯-tRNA佔據後,50S核糖體亞基23S rRNA的核苷酸U2620(E. coli中為2585)、A2486(2451)和C2106 (2063)將位於它們之間的羧基夾持,使其取向變為面對A位點。因為從酯基平面發起的最佳進攻角度約為105°,所以新取向能防止羧基受到任何來自A位點的親核進攻。當具有完整CCA序列的tRNA的接納莖結合在A位點時,該tRNA分子中的C74與核苷酸U2590(2555)發生堆疊後便誘導50S核糖體亞基產生構象上的變化,令核苷酸U2541(2506)、U2620(2585)發生越過G2618(2583)的運動。鹼基之間相對位置的改變讓酯基獲得一個可接受來自A位點親核進攻的新構象。
核苷酸A2486(2451)的N3是離50S核糖體亞基中正在形成的肽鍵最近的原子,它可能具有使A位點中的氨基醯-tRNA的氨基更易於發動親核進攻的作用。A2486(2451)通過一種電核中繼機制( charge relay mechanism)使其pKa提高5個單位並與該氨基間形成氫鍵以增大自身的親核性。A2486(2451)能和與A2486(2450)嵌入的磷酸基以氫鍵連接的G2482(G2447)相互作用。該嵌入磷酸基可使這兩個稀有的亞胺基異構化的鹼基更穩定,並令N3擁有負電荷密度。
輔助蛋白質形成
50S核糖體亞基在體內(in vitro)及體外(in vivo)都可扮演摺疊多肽鏈的角色。[4]在該過程中,50S核糖體亞基為肽鏈疏水折攏步驟提供了一個疏水表面。新合成的肽鏈需完全進入50S核糖體亞基以完成摺疊。這個步驟需要消耗一定的時間(如β-半乳糖苷酶5min)。
參見
參考文獻
- ↑ Ban N, Nissen P, Hansen J, Moore P, Steitz T. The complete atomic structure of the large ribosomal subunit at 2.4 A resolution. Science. 2000, 289 (5481): 905–20. doi:10.1126/science.289.5481.905. PMID 10937989.
- ↑ Nissen P, Hansen J, Ban N, Moore P, Steitz T. The structural basis of ribosome activity in peptide bond synthesis. Science. 2000, 289 (5481): 920-929. doi:10.1126/science.289.5481.920.
- ↑ Schmeing T, Huang K, Strobel S, Steitz T. An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature. 2005, 438: 520-524. doi:10.1038/nature04152.
- ↑ Basu A, Ghosh J, Bhattacharya A, Pal S, Chowdhury S, DasGupta C. Splitting of ribosome into its subunits by unfolded polypeptide chains. Current Science. 2003, 84: 1123-1125.
外部連結
|
|||||||||||||||
| 關於「50S核糖體亞基」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |