硫
| A+醫學百科 >> 硫 |
| 硫 | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
16S
|
|||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||
黃色晶體 硫的原子光譜 |
|||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 硫(Sulfur)·S·16 | ||||||||||||||||||||||||||||||||||||
| 元素類別 | 非金屬、氧族元素 | ||||||||||||||||||||||||||||||||||||
| 族·周期·區 | 16·3·p | ||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 32.066(4) | ||||||||||||||||||||||||||||||||||||
| 電子排布 |
[Ne] 3s2 3p4 |
||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||
| 發現 | 中國人(早於公元前2000年) | ||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||
| 物態 | 固體 | ||||||||||||||||||||||||||||||||||||
| 密度 | (接近室溫) (斜方硫) 2.07 g·cm−3 |
||||||||||||||||||||||||||||||||||||
| 密度 | (接近室溫) (單斜硫) 1.96 g·cm−3 |
||||||||||||||||||||||||||||||||||||
| 熔點時液體密度 | 1.819 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| 熔點 | 388.36 K,115.21 °C,239.38 °F | ||||||||||||||||||||||||||||||||||||
| 沸點 | 717.8 K,444.6 °C,832.3 °F | ||||||||||||||||||||||||||||||||||||
| 臨界點 | 1314 K,20.7 MPa | ||||||||||||||||||||||||||||||||||||
| 熔化熱 | 1.727 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 汽化熱 | 45 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 比熱容 | 22.75 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||
| 氧化態 | 6, 5, 4, 3, 2, 1, -1, -2 (強酸性) |
||||||||||||||||||||||||||||||||||||
| 電負性 | 2.58(鮑林標度) | ||||||||||||||||||||||||||||||||||||
| 電離能 |
第一:999.6 kJ·mol−1 |
||||||||||||||||||||||||||||||||||||
| 共價半徑 | 105±3 pm | ||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 180 pm | ||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||
| 晶體結構 |
orthorhombic |
||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)(無定形硫) 2×1015 Ω·m |
||||||||||||||||||||||||||||||||||||
| 熱導率 | (無定形硫) 0.205 W·m−1·K−1 |
||||||||||||||||||||||||||||||||||||
| 體積模量 | 7.7 GPa | ||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 2.0 | ||||||||||||||||||||||||||||||||||||
| CAS號 | 7704-34-9 | ||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||
|
主條目:硫的同位素
|
|||||||||||||||||||||||||||||||||||||
硫是一種化學元素,在元素周期表中它的化學符號是S,原子序數是16。硫是一種非常常見的無味無嗅的非金屬,純的硫是黃色的晶體,又稱做硫磺。硫有許多不同的化合價,常見的有-2, 0, +4, +6等。在自然界中它經常以硫化物或硫酸鹽的形式出現,尤其在火山地區純的硫也在自然界出現。對所有的生物來說,硫都是一種重要的必不可少的元素,它是多種胺基酸的組成部分,由此是大多數蛋白質的組成部分。它主要被用在肥料中,也廣泛地被用在火藥、潤滑劑、殺蟲劑和抗真菌劑中。
目錄 |
主要特徵
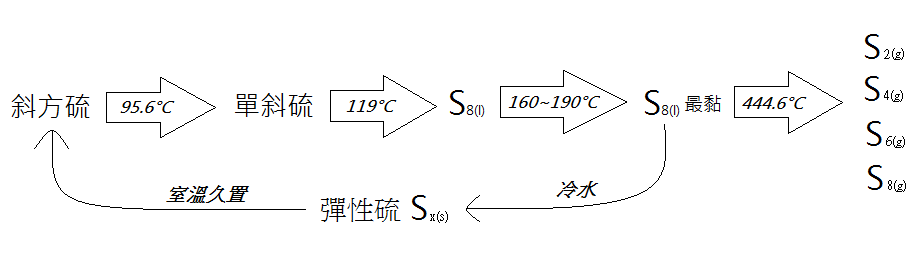
純的硫呈淺黃色,質地柔軟,輕。與氫結成有毒化合物硫化氫後有一股臭味(臭雞蛋味)。硫燃燒時的火焰是藍色的,並散發出一種特別的硫磺味(二氧化硫的氣味)。硫不溶於水但溶於二硫化碳。硫最常見的化學價是-2、+2、+4和+6。在所有的物態中(固態、液態和氣態),硫都有不同的同素異形體,這些同素異形體的相互關係還沒有被完全理解。晶體的硫可以組成一個由八個原子組成的環:S8。
硫有兩種晶體形式:斜方晶八面體和單斜棱晶體,前者在室溫下比較穩定。
用途
硫在工業中很重要,比如作為電池中或溶液中的硫酸。硫被用來製造火藥。在橡膠工業中做硫化劑。硫還被用來殺真菌,用做化肥。硫化物在造紙業中用來漂白。硫酸鹽在煙火中也有用途。硫代硫酸鈉和硫代硫酸氨在照相中做定影劑。硫酸鎂可用做潤滑劑,被加在肥皂中和輕柔磨砂膏中,也可以用做肥料。
生理作用
半胱氨酸、蛋氨酸、同型半胱氨酸和牛磺酸等胺基酸和一些常見的酶含硫,因此硫是所有細胞中必不可少的一種元素。在蛋白質中,多肽之間的二硫鍵是蛋白質構造中的重要組成部分。有些細菌在一些類似光合作用的過程中使用硫化氫作為電子提供物(一般植物使用水來做這個作用)。植物以硫酸鹽的形式吸收硫。無機的硫是鐵硫蛋白的一個組成部分。在細胞色素氧化酶中,硫是一個關鍵的組成部分。
工業和發電廠燃燒煤釋放出來的大量二氧化硫在空氣中與水和氧結合形成硫酸,它造成酸雨降低水和土壤的pH值,對許多地區的自然環境造成巨大破壞。
歷史
在古代人類就已經認識硫了。中國人發明的火藥是硝酸鉀、碳和硫的混合物。1770年代安托萬·拉瓦錫證明硫是一種元素。
來源
[[File:Fumarole with sulfur.jpg|thumb|250px|陽明山國家公園地熱氣井與硫磺 [[File:北投硫磺礦.jpg|thumb|250px|陽明山國家公園氣井的硫磺 在自然界中硫主要以硫化物(如黃鐵礦)和硫酸鹽(如石膏)的形式出現,在熱泉和火山地區也有純的硫存在。除此以外一些礦物如辰砂、方鉛礦、閃鋅礦和輝銻礦等也都是硫化物的礦物。煤和石油中也含少量硫,這是為什麼在燃煤和石油時有二氧化硫被釋放出來(酸雨)。今天許多國家要求燃燒煤和石油時被釋放的二氧化硫要進行回收。這些被回收的硫是今天工業中使用的硫的一個重要來源。此過程通常通過一個叫做「克勞斯工藝」的過程來實現。另一個重要來源是硫礦。
在工業中,最重要的硫的化合物是硫酸。硫酸是所有工業過程中必不可少的一個原材料,因此硫酸的消耗量被看做是一個國家工業化程度的一個指標。在美國硫酸是所有生產得最多的化合物。
木衛一表面的黃色主要是它的火山釋放的硫造成的。月球上阿利斯塔克環形山中比較暗的地區可能是硫形成的。在許多隕石中有硫。基於人類對外星資源的興趣強烈提升,木衛一的硫磺也曾經是研究考慮開採的對象;然而成本驚人,除了構想以外,並未付諸實行。
化合物
許多有機物難聞的味道來自於它們所含有硫化氫之類的化合物。這些化合物有一股特別的臭雞蛋味道。硫化氫的溶液是酸性的,與金屬反應形成金屬的硫化物。鐵的硫化物在大自然中很常見,被稱為黃鐵礦。有趣的是黃鐵礦有半導體的特性。方鉛礦是硫化鉛,也是第一種被發現的半導體。
聚合的氮化硫有金屬特性,儘管它不含任何金屬,這個複合物還顯示特別的電學和光學特性。讓熔化的硫速凝可以獲得無晶態的硫,倫琴衍射顯示其中含有由八個硫原子組成的環。這種硫在室溫下不十分穩定,它漸漸恢復為晶體狀態。
其它重要的硫的化合物有:
- 連二亞硫酸鈉:Na2S2O4,是一種強有力的還原劑
- 亞硫酸:H2SO3,是二氧化硫在水中的溶液。亞硫酸和亞硫酸鹽是有力的還原劑。二氧化硫的其它產物包括焦亞硫酸離子(S2O52−)
- 硫代硫酸物:S2O32−,是氧化物。硫代硫酸氨有可能可以代替氰化物來洗金
- 連二硫酸:H2S2O6,及其鹽
- 連多硫酸:H2SnO6,n可以從3一直到80
- 硫酸鹽:是硫酸的鹽
- 硫化物:是硫與其它元素的化合物
- 過一硫酸是三氧化硫與濃的過氧化氫的反應物
- 硫氰酸鹽是硫氰離子(SCN−)的化合物
- 硫氰:(SCN)2
- 二硫化碳:一種良好的有機溶劑,通常用於紡織工業,工業上通過甲烷與硫磺反應來生產
同素異形體
- 斜方硫(菱形硫): Dolomite Rhombic sulfur
- 化學式:S8
- 是硫由二硫化碳結晶而得之緊密的黃色晶體,熔點112.8度。
- 單斜硫:Monoclinic sulfur
- 彈性硫: Plastic sulfur
- 化學式:S8
- 為沸騰之硫注入冷水所得之軟黏體,有彈性。
同位素
硫有18種同位素,其中四種是穩定的:S-32(95.02%)、S-33(0.75%)、S-34(4.21%)和S-36(0.02%),除35S外,其它放射性同位素的半衰期都很短。硫-35由宇宙射線射擊空氣中的氬-40而導致,其半衰期為87天。
硫化物沉澱時根據溫度的不同S-34的含量少許不同。假如在一個礦物中硫化物和碳酸鹽同時存在的話,那麼根據碳-13和硫-34的含量可以推算出礦物形成時礦水的pH值和氧的逸度。
在森林生態系統中,硫酸鹽主要來自空氣,少量來自礦物的風化。其中硫的同位素的不同含量可用來確定它們的來歷。
注意
在接觸二硫化碳、硫化氫和二氧化硫時要非常小心。
二氧化硫可以在肺中與水結合成亞硫酸,亞硫酸可以導致肺出血和窒息。
硫化氫毒性非常高,甚至高於氰化物。雖然硫化氫的味道一開始非常強烈,但人的嗅覺很快就被它壓抑了。因此受害人有可能未察覺它的存在。
參考來源
| 關於「硫」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |