生物化學與分子生物學/纖維蛋白原轉變為纖維蛋白
| 醫學電子書 >> 《生物化學與分子生物學》 >> 血漿蛋白與凝血 >> 血液凝固 >> 纖維蛋白原轉變為纖維蛋白 |
| 生物化學與分子生物學 |
|
|
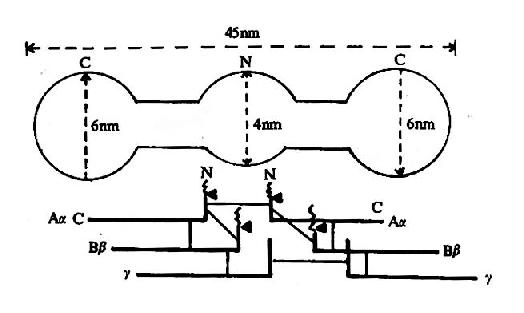
圖10-8 纖維素蛋白原分子示意圖
上半為電鏡下的分子形狀 下半示6條多肽鏈,
一為雙硫鍵,▲為凝血酶作用點
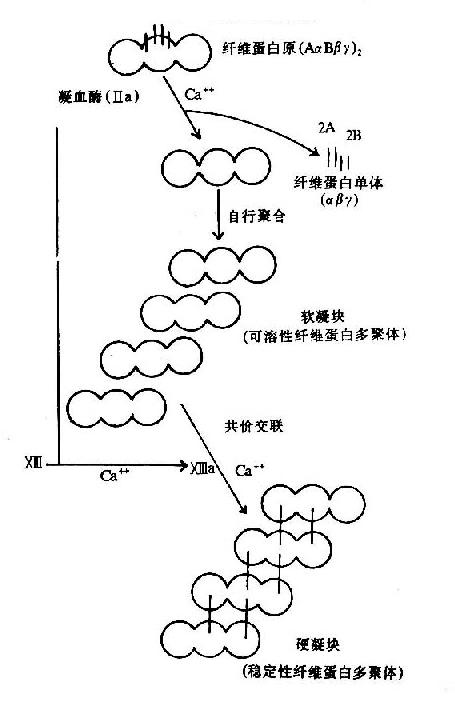
圖10-9 纖維素蛋白凝膠的生成
血液凝固的實質是纖維蛋白凝膠的生成,它是血漿中纖維蛋白原(fibrinogen)在凝血酶作用下降解為纖維蛋白並聚合成不溶性的網狀結構。
纖維蛋白原分子由兩對α鏈、β-鏈及γ-鏈組成,每3條肽鏈(α、β、γ)絞合成索狀,形成兩條索狀肽鏈,在N末端有二硫鍵使態個分子得到穩定。α及β肽鏈的N-端分別有一段16個及14個胺基酸的小肽,稱為纖維肽A及B。因此,纖維蛋白原可寫為(AαBβγ)2(圖10-8)。
凝血酶的本質為一種蛋白水解酶,能特異性作用於Aα和Bβ鏈上的精-甘肽鍵。切除A、B纖維肽。因纖維肽A及B均為酸性肽,帶較多負電荷。由於電荷排斥作用阻礙纖維蛋白原之間聚合。切除纖維肽A及B轉變為纖維蛋白後負性減小,同時暴露了互補結合位點,有利於自動聚合,纖維蛋白單位通過邊靠邊、端靠端的聚合形成聚合鏈。此種多聚體不穩定,稱為軟凝塊(soft clot)。它再通過因子XⅢa的作用結成牢固的網。因子XⅢa為轉肽酶,能催化一個單體的谷氨酸殘基的γ-羧基與另一單體的賴氨酸殘基的氨基之間形成共價結合,其間釋出NH3(圖10-9,10)。因此,因子XⅢa稱為纖維蛋白穩定因子(fibrin stabilizingfactor,FSF)。因子XⅢ存在於血小板及血漿中,經凝血酶切除部分肽段後被激活為XⅢa。
由此產生的穩定纖維蛋白網與軟凝塊不同,它們在5M的脲及1%氯乙酸溶液中不溶解。在血小板的血栓收縮蛋白作用下,此網狀結構收縮,於是傷口邊緣彼此靠近,易於傷口閉合。成纖維細胞的表面帶有一種類似纖維蛋白的蛋白質,稱粘連蛋白,它由Ⅻa催化與纖維蛋白結成網。並將纖維蛋白固定下來。所以,因子Ⅻa還直接參与傷口的癒合。
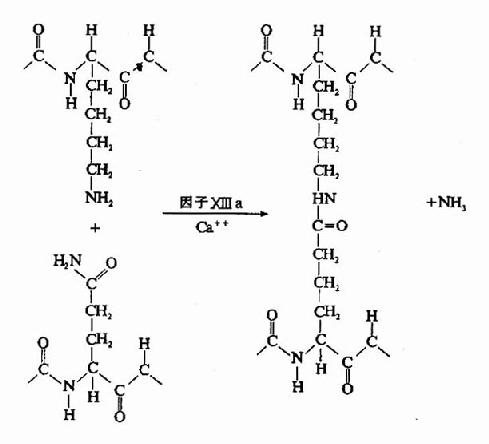
圖10-10 因子XⅢa作用機理
總結上述凝血過程可歸納出以下特點:
1.凝血因子的活化本質上為蛋白質的有限水解,而許多凝血因了本身既是蛋白酶,又是酶作用的底物。這些本質為蛋白酶的凝血因子(Ⅱ、Ⅵ、Ⅺ、Ⅹ、Ⅻ)的胺基酸順序很相似,與許多絲氨酸蛋白酶同源;活性中心的絲氨酸殘基參與肽鍵的水解。C-端約250個胺基酸殘基同源性很高,是具有催化活性的結構域。而N端的胺基酸序列變化較大,決定各凝血因子作用底物的專一性。它們催化的反應需Ca++和磷脂參加。
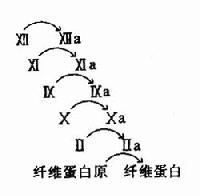
圖10-11 血液凝固的瀑布效應
2.磷脂膠粒(內源性途徑由血小板,外源性途徑由組織凝血活素提供)使活化反應在膠粒表面進行,大大提高反應速度,而Ca++的作用在於促進酶和底物與磷脂表面的結合。
3.凝血因子活化呈瀑布效應(cascade)使血液凝固具有高效率和精密調控的特徵。如圖10-11所示。
4.維生素K在內、外源性凝血中均有重要作用。
5.凝血過程中的正反饋使反應不斷加速,但終產物纖維蛋白有抗凝血作用。機體內凝血與抗凝血是密切聯繫的。
| 關於「生物化學與分子生物學/纖維蛋白原轉變為纖維蛋白」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |