生物化學與分子生物學/凝血酶原的激活
| 醫學電子書 >> 《生物化學與分子生物學》 >> 血漿蛋白與凝血 >> 血液凝固 >> 凝血酶原的激活 |
| 生物化學與分子生物學 |
|
|
|
凝血酶原(Ⅱ,prothrombin)是含582胺基酸殘基的酶原,被因子Xa在Arg-Thr及Arg-Ile處切開,切除N端274個胺基酸殘基,餘下308個胺基酸殘基分成A、B兩條肽鏈,由一個硫鍵相連,即為凝血酶(thrombin)。(圖10-5)因子Va無酶活性,但可使Xa的活性增強350倍,加速凝血酶的生成。磷脂膠粒與酶(Xa)和底物(凝血酶原)之間借Ca++作為橋相連。因凝血酶原肽鏈的N未端含有10個γ羧基谷氨酸殘基。相鄰的羧基可與Ca++形成複合體。另一方面,Ca++又可與磷脂中磷酸基結合,這樣使Xa和Va與凝血酶原接觸在一起,於是Xa將凝血酶原水解為凝血酶(圖10-6)。
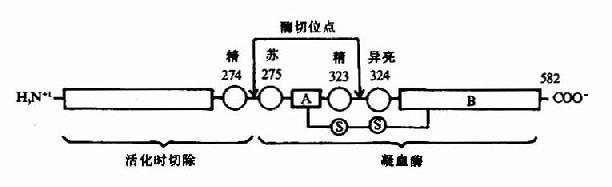
圖10-5 因子Xa激活凝血酶原示意圖
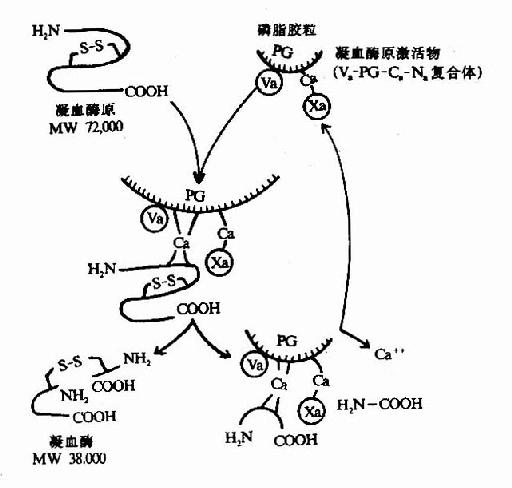
圖10-6 凝血酶的生成
凝血酶原及因子Ⅶ、Ⅺ、Ⅹ均由肝合成,合成過程中需要維素K作為輔因子。缺乏Vitk則生成異常凝血酶原,只有正常活性的1?%。研究表明Vitk參與凝血酶原γ羧基谷氨酸的生成。Vitk參與羧基化的機理為:氫醌型Vitk在酶的催化下奪去γC上的一個質子,使γ-C呈陰離子,而和CO2結合。2,3環氧Vitk則在酶催化下被硫辛酸還原而重複利用,因而Vitk在此羧化反應中起輔酶的作用。(圖10-7)
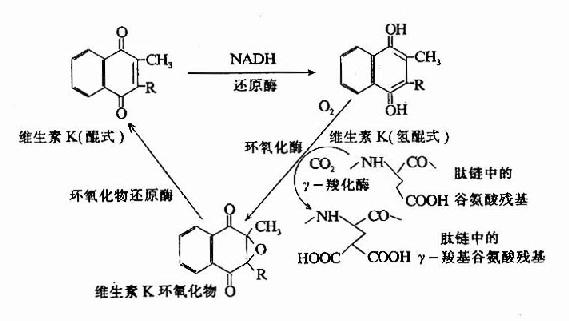
圖10-7 維生素K在谷氨酸殘基r-羧化反應中的作用(維生素K循環)
出自A+醫學百科 「生物化學與分子生物學/凝血酶原的激活」條目 http://cht.a-hospital.com/w/%E7%94%9F%E7%89%A9%E5%8C%96%E5%AD%A6%E4%B8%8E%E5%88%86%E5%AD%90%E7%94%9F%E7%89%A9%E5%AD%A6/%E5%87%9D%E8%A1%80%E9%85%B6%E5%8E%9F%E7%9A%84%E6%BF%80%E6%B4%BB 轉載請保留此連結
| 關於「生物化學與分子生物學/凝血酶原的激活」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |