臨床生物化學/連續監測法測酶活性濃度
| 醫學電子書 >> 《臨床生物化學》 >> 血清酶定量的檢測技術 >> 測定酶活性濃度的兩大類方法 >> 連續監測法測酶活性濃度 |
| 臨床生物化學 |
|
|
連續監測法具有眾多的優點,隨著科學技術的發展,自動生化儀的使用,正在逐步取代「固定時間法」,已開發國家從50年代到70年代末用了約20餘年的時間,我國從80年代初開始使用連續監測法,雖然發展很快,但至少仍有不少地區醫院實驗室仍使用老的方法,就是已使用新法的實驗室,也不一定掌握得很好,本節將比較詳細地從分類,酶偶聯反應,測定注意事項等方面對連續監測法加以介紹。
(一)連續監測法種類
⒈直接連續監測法這類方法是使用各種分析手段,如分光亮度法、熒光法、pH計、旋光計、電導儀等等,在不停止酶反應條件下直接測反應體系中底物或產物的變化,從而計算出酶活性濃度,其中尤以分光光度法應用最多,應用最廣的有NAD(P)H反應系統,可以測定大部分的脫氫酶,還有的是所謂「色素原」底物,其本身為無色或微黃色,在酶作用下生成有色化合物,適用於測定水解酶和一些轉移酶。
⒉間接連續監測法直接法試劑簡單,操作方便,可惜的是只有當底物與產物之間,在光學性質或其它理化性質有顯著差異時,才有可能使用此法。到目前為止,大部分酶都無法用直接法測定。
科學家還曾設法在原來反應體系中添加一些試劑,這些試劑必須不與酶作用也不影響酶活性,同時又能與酶反應物迅速作用,產生可以被直接測定的物質,典型的例子是Ellman的膽鹼酯酶測定法,底物為硫代乙醯膽鹼,酶水解產物硫代膽鹼與添加的二硫代硝基苯甲酸(DTNB)作用立刻生成黃色化合物,可在412nm用分光光度法連續監測。
實際工作中,更多的是在反應體系中加入另一酶試劑。進行適當的酶促反應,完全可以勝任上述工作。目前酶偶聯法已經成為應用最廣、最頻繁測酶活性濃度的方法。
最簡單的酶偶聯反應為以下模式:
![]()
Ex為所要測定的酶,A、B二物質分別為其底物和產物,對此二物質變化,無法直接監測,此時可加入其它酶,其底物為Ex的產物B,其反應產物C可直接監測,這樣通過第二個酶反應有可能推測出第一個酶的活性濃度,外加的第二個酶稱之為指示酶Ei。
如果一些酶反應找不到合適的指示酶與其直接偶聯,此時往往可以加入另一種酶,將二者連接起來,模式如下:
![]()
將這種聯接的酶稱之為輔助酶(Ea)。個別情況可能使用二種乃至二種以上的輔助酶。
酶偶聯反應與一般酶反應的一個重要區別處在於其有一個明顯的延滯期。酶偶聯反應一開始只存在著底物A,不存在指示酶的反應,隨著產物B的出現和增加,指示酶反應隨之加快,Ex和Ei反應速度相等,也就是達到穩態。從酶反應開始至穩態期間,指示酶反應較慢且不穩定,稱為延滯期。顯然這期間指示酶反應速度不能代表測定酶量多少。設計或選擇酶測定方法時,如果用酶偶聯法,延滯期越短越好,測定時間一定要避開此期。
是不是所有類型的酶偶聯反應都可用來測酶活性濃度?回答是否定的。因為測酶的活性濃度是依據測定酶反應速度——△A/△t或△B/△t求出。在酶偶聯法,此值無法直接求出,而是通過測定指示酶反應△C/△t間接求出,要使酶偶聯法測得的酶活性濃度準確可靠,則Vind=Vx。換言之,指示酶的最大反應速度必須等於或接近測定酶的最大反應速度。
當測定酶的反應速度明顯大於指示酶,此時A很快轉變為B,由於指示酶反應慢,中間產物B大量推積,最終產物產生速度明顯慢於底物A的消失速度。
當指示酶速度加大後,中間產物B堆積減小,指示酶反應速率偏差程度也變小。只有當指示酶大量存在時,出現產物B就能將其迅速變為C。
可以看出在延滯期後(即B達到高峰後的時期),C和A的變化速度非常一致。也就是只有在些情況下,才是測定酶濃度的理想條件。
從理論上說,用酶偶聯反應測酶活性濃度時,最好條件應是測定酶反應為限速反應。動力學上為零級反應,而指示酶為一級反應,酶反應速度與指示酶底物濃度相關。
(二)指示酶、輔助酶的種類和濃度
指示酶、輔助酶的種類:常規化驗中常用的酶偶聯法中,多以脫氫酶為指示酶,在常規化驗中的自動分析儀幾乎無一例外都有340nm波長,通過NAD(P)H系統可以很方便地監測到指示酶反應。但從理論上說,往往可以有不止一種偶聯方法,只要設法使偶聯反應中最後一個是指示酶反應,前面已提到測CK可以正向逆向二個向建立二種不同酶偶聯的反應。又如在丙氨酸轉氨基酶(ALT)測定法中,正向反應後產生丙酮酸和谷氨酶,目前最常用的是用乳酸脫氫酶與丙酮酸偶聯反應,伴有NADH下降。但也可以用谷氨酸脫氫酶與谷氨酸作用,伴有NADH生成。
總之,酶偶聯法為實驗室工作者開闢了一個廣闊前景。在設計和選擇測定酶活性濃度方法時,應該創造更新的方法,而不應拘泥於書本上的方法。
在選擇時首先應考慮方法的特異性。在ALT方法,測定丙酮酸顯然優於測谷氨酸,因為多種氨基轉移酶都能產生谷氨酸,而只有ALT產生丙酮酸。還有干擾反應或副反應,在ALT測定中,由於正常以及病理血清中含有一定量丙酮酸,將受到它的干擾,又由於底物中含有大量α-酮戊二酸,可被血中谷氨酸脫氫酶作用消耗NADH。
其次應考慮酶偶聯反應的合理性,如能直接與指示酶偶聯,就沒有必要加入輔助酶,所選用的指示酶、輔助酶除了應選Km小的酶(這樣容易使它們催化反應速度大大超過測定酶反應速度),還必須考慮指示酶、輔助酶是在測定酶的「最適條件」下工作,此時往往不是指示酶、輔助酶的最適條件,如二者差異太大不利於整個酶系統的反應,例如乳酸脫氫酶最適pH為7.4,而丙氨酸氨基轉移酶最適pH也是7.4,乳酸脫氫酶作為指示酶比谷氨酸脫氫酶更為合適,因後者最適pH為8.4。
如最後製成試劑盒,則還需從經濟角度選擇一些價廉物美,又易取材、純化得到的酶製劑。
(三)指示酶、輔助酶的濃度
從上節描述中可以知道建立一個合適的酶偶聯反應體系,不是很容易的指示酶,輔助酶的反應要能準確反映出測定酶含量,中間產物必須低,延滯期必須短,要作到此點,這些工具酶用量很大,但用量過大經濟上不合算,所以在酶偶聯測定法中,選用適當量的指示酶是一個重要的問題。一般可用反覆試驗法,即試驗性地選用不同量的指示酸直到偶聯酶反應中指示酶反應速度不隨工具酶的增加而升高,並在所選用的「最適條件」下,指示酶反應速度和酶活性濃度成正比例。
這種方法工作量大,而且不一定能得到最適結果,較好的辦法是可先從理論上進行計算,得出一個大約結果,然後在此範圍內進行試驗,這樣可以節約時間和精力。
最簡單的方法是根據Vx/(Km)x=Vi/(Km)i的比值來選擇指示酶的用量Vi,式中Vx為測定酶的測定上限,(Km)x和(Km)i分別是測定酶和指示酶的米氏常數;有人計算過當比值為1:100時,測定值低4%;如改為1:10時,指示酶的反應速度將比測定酶反應速度慢28%,如增加到1:1000,則誤差只有0.7%。
這是因為,當我們用酶偶聯反應體系測酶活性濃度時,測定酶的反應必須是體系中的限速反應,工具酶所催化的最大反應速度必須遠遠大於測定酶,由於工具酶所催化的反應必須在中間產物濃度很低條件下進行,並且將其很快轉變為最終產物,反應體系中不應有中間產物堆積,否則將導致誤差。
下面舉一實例,在肌酸激酶測定法中,CK的Km為2.4mmol/L,指示酶6-磷酸葡萄糖脫氫酶的Km為0.27mmol/L,如我們將CK測定上限定為450μ/L(實際測定時標本稀釋60倍,實際為7.5μ/L),如希望上述比例為1:100。代入上式:
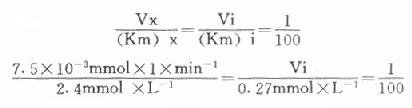
Vi=3.1×10-3×min-1×0.27mmol×1
=0.835×10-3×mmol×min-1
=0.835U
如反應體系為1ml,求出在此反應體系中只需0.835U的6-磷酸葡萄糖脫氫酶即可。
另一法可以根據米氏方程式來計算,在酶偶聯反應中,指示酶催化速度(Vi)的米氏方程式為:
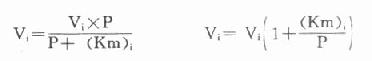
以天冬氨酸氨基轉移酶(AST)為例希望中間產物P濃度很低,定為0.001mmol/L,指示酶蘋果酸脫氫酶。Km為0.0165mmol/L,如設定AST上限為300U/L(標本為1:12稀釋,實測上限為25U/L)。代入上式:
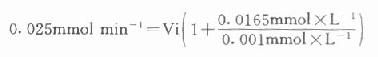
Vi=0.0014mmol min-1=1.4U
得1.4U,如反應體系為3ml,則試劑中蘋果酸脫氫酶用量為466U/L,目前試劑中用量為600U/L。從以上計算來看,試劑中用量是足夠的。
在酶偶聯反應體系中,不可避免會出現延滯期,在測定酶時希望此延滯期愈短愈好,此時可利用Mcclure介紹的計演算法計算出一定延滯期時所需指示酶的量。
Mcclure假定在下面酶偶聯反應中:
![]()
第一個反應為零級反應,第二個反應為一級反應,且中間產物B濃度遠小於指示酶的Km,即B<<(Km)i。
通過推導,可得
dB/dt=k1-k2B
上式積分得:
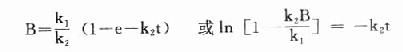
當t足夠大時,e-k2t→0,此時B濃度不變達到穩態,此時B的濃度為Bss,代入上式:
首先可得 Bss=k1/k2
以及ln[1-B/Bss] =-k2t
同時在穩態下,k2是指示酶正向反應的常數,在一級反應中k2=Vi/(Km)i。
令F=B/Bss,此即在時間t時產物B為其穩態濃度的百分數,一般選用0.99。
最後可得公式:
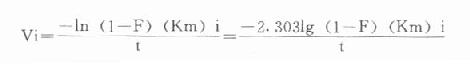 Vi=
Vi=
例如在CK測定中,指示酶6-磷酸葡萄糖脫氫酶Km為0.11mmol/L,我們希望延滯時間為1分鐘,則指示酶用量為:
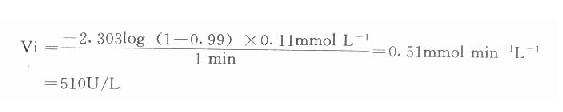
總之,從上式可清楚看到,延滯時間t與指示酶的Km成正比例,用量成反比。
| 關於「臨床生物化學/連續監測法測酶活性濃度」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |