臨床生物化學/酶活性的濃度單位
| 醫學電子書 >> 《臨床生物化學》 >> 血清酶定量的檢測技術 >> 測定酶活性濃度的兩大類方法 >> 酶活性的濃度單位 |
| 臨床生物化學 |
|
|
50年代以前酶活性濃度單位的命名混亂,常以方法提出者的姓氏來命名,例如澱粉酶的Somogyi單位,鹼性磷酸酶的King單位等等,定義參差不齊,給臨床醫師帶來很大不便,尤其在建立「連續監測法」測酶後,大量酶應用於臨床,此混亂現象更為突出。1963年國際生化協會通過廣泛討論,提出一個國際單位定義來表示酶量的多少,即1分鐘能轉化1微摩爾底物(μmolmin-1)的酶量為一個國際單位,以IU表示之,由於意見不一致,至今尚未指定酶反應溫度,而同一量的酶,在不同溫度時間為1分鐘所轉化底物的量將有明顯差異。為避免臨床上誤認為只要是同一國際單位的酶量在國際上無論何處所測結果都應一致,目前大多數實驗工作者常省略國際二字(簡寫也由IU改為U)。
臨床上測定的不是酶的絕對量而是濃度,1963年並未明確規定用ml或L表示體積。舊的文獻中可見到mU/ml,或U/L。目前在臨床化學中,幾乎都習慣用U/L來表示體液中酶活性濃度。我國由於近年來大量用自動分析儀和連續監測法測酶,已逐步不再使用各種古老單位,而使用U/L來表示酶活性濃度。
近年來國際上大力推廣SI制,我國已明確SI製為法定計量單位制,SI制中酶活性單位為Katal,即1秒中轉化1個摩爾底物(mol s-1)的酶量,Katal對體液中酶量而言顯然過大,常用單位為ukatal或nkatal。
上述國際單位和katal間關係如下:
1U=1μmol min-1=16.67nmol s-1=16.67nkatal
在我國不論實驗室還是臨床醫師對katal都不太熟悉,如報告使用katal/L報告酶結果時,最好同時註明相應的U/L。
(一)連續監測法中酶活性濃度的計算
前面已提到連續監測法優點之一是計算方便,不需作標準曲線或標準管,用分光光度計監測酶反應過程時,很容易求出反應體系每分鐘吸光度變化,根據摩爾吸光係數可求出△A相當測定物質變化的微摩爾數,由於臨床醫師需要知道的是標本中而不是反應體系中酶的濃度,計算中要考慮標本的稀釋倍數,假如比色杯光徑不是1cm,則還應考慮光徑不同對△A的影響,這樣整個計算公式應為:
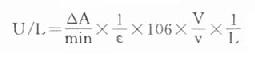
此中ε為摩爾(線性)吸光體系(mol-1.L.cm-1)
△A為吸光度變化
v為標本體積(ml)
V為反應體系體積(ml)
L為光徑(cm)
在實際測定中後面幾項皆為常數,所以上式常簡化為:
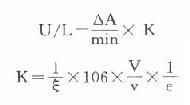
(二)常數K的意義和設置
在測酶時,常數K值的選擇是很重要的。此值過高雖然測定的線性範圍較寬,但重複性差,反之,雖然精密度好,但線性窄。
此問題與儀器測定的嗓音(noise)密切相關,自動分析儀吸光度讀數嗓音一般都需控制在0.001,也就是儀器須保證對同一溶液反覆進行測定時,吸光度誤差最好控制0.001上下,雖然此值不大,但已可能使測定結果產生1/1000K值的誤差,如K值為6000,代入上式,則每分鐘測定吸光度如有0.001微小變化,結果將是出現上下6U/L的誤差,對於一此參考值較低的酶,如轉氨酶而言顯然太大,臨床醫師無法容忍這麼大差異。
K值設置的首先出發點應是測定酶的判斷值或參考值上限,應保證這些值測定的可靠,所以轉氨酶的常數K一般在3000左右,不少人寧願在1500左右,另外還應考慮到測定時間,一些半自動分析儀測定時間短到0.5分,此時0.001嗓音對每分鐘△A誤差將是0.002,反之,測定時間延長到2分鐘,誤差也小一半,也就是說,如測定時間長,則K值可以設置大一些,如測定時間只有0.5分鐘,K值一般不超過4000。
改變K值最方便的途徑就是改變標本稀釋度,稀釋倍數愈大,K值愈大。
(三)常數K值的檢驗
摩爾吸光係數(ε)對一定物質而言常是一個定值,但在一些外界條件影響下也會有所變化。最明顯例子是對硝基酚,隨pH不同,顏色差異明顯,當pH>10時,405nm處其ε為18500,在pH7.0,ε下降為9400,顏色下降幾乎一半。溫度變化時,也會對NAD(P)H的ε產生一些影響。當波長大於334nm時,隨溫度升高,同一波長的ε值會輕度下降。
同時ε值是指用分光光度法,也就是在近似單色光的光源條件下才能成立,實際上大多數自動分析儀使用的是干涉濾片,波峰值可能出現差異,個別的半波寬可能為10nm乃至更大。由於雜散光的存在,會明顯改變ε值,假如再考慮到注加系統的誤差,實測K值很可能與理論K值不一致。Onuki檢測了三台Hitachi-7150型自動分析儀測AST的K值分別為-5466、-5421、-5559。而理論K值為-6111則結果約增加為1.12倍。
測定實際的K值不是一件困難的事,目前有些自動分析儀已有相應的軟體和試劑可以進行檢測。事實上對一些性質穩定的物質如對硝基酚、對硝基苯胺,可以用高純試劑配成標準品或直接購買可靠的校準品,將它們作為標本進行酶的測定,根據已知標準品的濃度和吸光度變化就可計算出實際K值,但此法不適用於測與NAD(P)H反應有關酶測定的K值。因為NAD(P)H不穩定,此時可使用測葡萄糖的紫外分光光度法試劑盒,對已知濃度的葡萄糖標準品進行終點法測定,此法產生與葡萄糖相等摩爾數的NAD(P)H,故不難從吸光度變化求出K值,也有人用乳酸脫氫酶測已知量的丙酮酸來求K值。
| 關於「臨床生物化學/酶活性的濃度單位」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |