醫院藥學/藥學監督的組織網路與職責
| 醫學電子書 >> 《醫院藥學》 >> 醫院藥學監督 >> 藥學監督的組織網路與職責 |
| 醫院藥學 |
|
|
|
(一)醫院藥學監督部門與職責衛生部《醫院藥劑管理辦法》第一章總則第三條規定:醫院藥劑科負責本院藥劑工作,在院長直接領導下,按照《藥品管理法》及其實施細則監督、檢查本院各醫療科室合理使用藥品,防止濫用和浪費。《醫院藥劑管理辦法》第二章條規定:為協調、指導全院合理用藥和科學管理,縣以上醫院(含縣)要設立藥理委員會的主要任務是:審定本院用藥計劃;制(修)訂本院基本用藥目錄和處方手冊;審核本院新製劑;組織評價新老藥物的臨床療效與不良反應,提出淘汰品種意見;及時研究解決本院醫療用藥重大問題監督檢查本院貫徹執行藥政法規的執行情況。《醫院藥劑管理辦法》在藥劑科科的組織與任務中規定藥劑科要加強藥品質量管理,建立健全藥品監督和檢查制度,以保證臨床用藥安全有效。醫院藥事管理委員會是醫院藥學監督管理工作的樞紐,醫院藥劑科是醫院藥學監督的組織實施者。
(二)衛生行政部門的藥品監督管理機構與職責
1.監督管理機構(圖15-1)
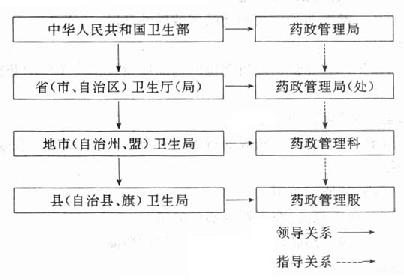
圖15-1我國藥品監督管理機構示意圖
《藥品管理法》第一章條規定:「國務院衛生行政部門主管全國藥品監督管理工作」。
在我國,衛生部設藥政管理局;各省、自治區、直轄市的衛生行政部門設藥政管理局(處);各地區行署(州)的衛生行政部門設藥政科。負責轄區內的藥品監督管理工作。
藥事管理的對象是人用藥品,管理的核心是藥品質量,管理的目的是確保藥品安全有效。
衛生行政部門的藥政、藥檢機構不同於藥品生產、經營、使用單位的藥品質量管理和檢驗機構,因為後者只對本單位的藥品質量負責,是行業內部的管理,而衛生行政部門的藥政機構則是代表國家對藥品進行監督、管理並執行裁決的單位。
2、監督管理機構的職責
(1)衛生部藥政管理局的職責範圍
①執行《藥品管理法》,擬定實施細則,監督檢查其貫徹執行情況。②審查批准新藥、頒布發「新藥證書」和批准文號。
③審批藥廠生產的新藥及質量標準。
④監督上市藥品、淘汰毒副作用大、療效不確切的藥品。
⑤管理麻醉藥品、毒性藥品、精神藥品和放射性藥品出口藥品准許證。
⑥負責進、出口藥品監督管理工作並發放進出口藥品准許證。
⑦監督檢查藥品生產、經營、使用單位的藥品質量以及醫療單位的藥劑工作。
⑧負責藥品宣傳管理。
⑨調查、處理藥品質量、中毒、事故。
⑩對違反《藥品管理法》用計有關法規的行為追查責任,進行處罰;對需要追究弄事責任的,向司法部門控告。
(2)省、直轄市、自治區衛生廳(局)所屬藥政處(局)的職責範圍。
除不擬定《藥品管理法》實施細則和審批新藥,頒發新藥證書外,其餘與上述職責相同。另外,還負責核發《製劑許可證》、《藥品經營企業許可證》、《藥品生產企業許可證》。
(3)取締假劣藥品
①監督、檢查《藥品管理法》在本地的實施情況。
②管理麻醉藥品、毒性藥品、精神藥品和放射性藥品。
③取締假劣藥品
④監督檢查藥品生產、經營、使用單位的藥品質量及醫療單位的藥劑工作。
⑤監督藥品宣傳。
⑥調查、處理藥品質量、中毒事故。
⑦對違反《藥品管理法》及有關法規的行為追查責任,進行處罰;需追究刑事責任時,向司法部門提出控告。
(4)縣(旗)藥政股的職責範圍
①監督、檢查《藥品管理法》在本轄區實施的情況。
②管理麻醉藥品、毒性藥品、精神藥品和放射性藥品。
③取締假劣藥品。
④監督檢查藥品生產、經營、使用單位的藥品質量及縣醫院製劑質量。
⑤監督藥品宣傳。
⑥調查、處理藥品質量、中毒事故。
⑦對違反《藥品管理法》及有關法規的行為追查責任,進行處罰。
(三)藥品檢驗所及其職責按轄區劃分,我國的藥栓所分為衛生部屬的中國藥品生物製品檢定所;省、自治區、直轄市藥品檢驗所;地(市、州、盟)藥品檢驗所;縣(旗)藥品檢驗所。
截止1986年,我國藥品檢驗機構已達1400餘個,在編人員達15000餘人,基本上形成質量監測網(圖15-2)
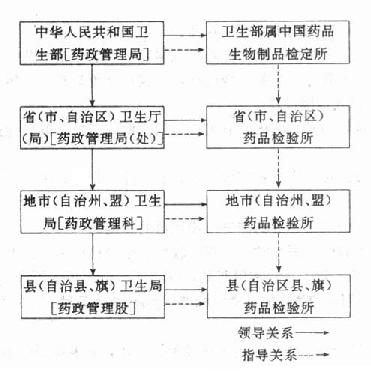
圖15-2我國藥品檢驗機構示意圖
1、衛生部屬中國藥品生物製品檢定所中國藥品生物製品檢定所是全國藥檢所的企業指導中心各級藥檢所受上級藥檢所指導。
中國藥品生物製品檢定所負責全國性藥品質量監督、檢驗和技術仲裁工作。有計劃地組織全國性藥品大檢查。參加《中國藥典》|《部頒藥品標準》的擬訂工作,負責新藥技術複核;藥品檢驗用國家標準藥品的研究、標定分發等工作。組織擬定全國藥檢科學技術複核;藥品檢驗用國家標準藥品的研究、標定分發等工作。組織擬定全國藥檢科學技術發展規劃;舉辦各種類型的藥檢專業進修班與藥檢情報交流等。
2、省、直轄市、自治區藥檢所負責本地區藥品質量監督、檢驗、仲裁工作;對當地藥廠、醫藥經營、醫療單位的藥品進行質量抽查,掌握藥品質量動態;擬訂、審查地方藥品標準;承擔上級藥檢所及國家交辦的藥品標準起草、標準品的標定、新藥技術複核及修訂藥品標準工作。
3、地(市、州、盟)藥檢所負責本地區藥品質量監督、檢驗、仲裁工作;對本地區醫藥生產負責審、複核、檢查;進行藥品質量抽查,掌握藥品質量情況;監督醫藥生產、供應、使用部門的藥品質量,指導縣(旗)藥檢所的業務工作。
4、縣(旗)藥檢所與地區藥檢所類同,但縣藥檢所應把藥事管理與藥品檢驗結合起來,重點是藥品監督。
(四)藥品標準中華人民共和國藥典是國家對藥品的質量規格和檢驗方法所做的技術規定,是藥品生產、檢驗、管理和使用等單位共同遵守的法定依據。凡正式生產、使用的藥品和和藥材制訂藥品標準,以便藉此衡量藥品的質量。藥品標準應力求確保藥品安全有效,檢驗技術先進,經濟合理。檢驗方法要符合準確、靈敏、簡便、快速的原則。既要考慮實際條件,又要反映新技術的應用和發展,注意引進國外先進技術。要從生產流程中摸清影響質量的因素。當生產工藝路線改變,原標準不能有效地控制該產品質量時,要修訂質量標準。藥品標準制訂或修訂都應有起草說明。
各種藥品標準的收載範圍:
1、中國藥典的收載範圍收載防病必需的,療效肯定,副作用小,有一定的標準規定能控制或檢定質量的品種。
(1)成批量生產、工藝成熟、質量穩定可工業生產的藥品。
(2)醫療常用,品種來源清楚,有鑒別真偽和必要的質量規定的中藥材及療效確切、資源豐富,科研成熟,在製劑中常用的草藥。
(3)使用面廣、處方合理、工藝成熟、原料容易解決的中成藥。
(4)對臨床必需的驗方、製劑,擇優選收。醫療常用敷料、基摶等也適當收載。
2、部頒標準的收載範圍
(1)中國創新重大品種、國內沒有生產過的放射性藥品、麻醉性藥品、中藥人工合成品、避孕藥品。
(2)上版藥典收載過,而現行版本未列入的、療效肯定,國內幾省仍在生產、使用並需修訂標準的藥品。
(3)療效肯定,但質量標準仍需進一步改進的新藥。
(4)地方標準收載的,醫療常用、療效較好、生產地區多,需要統一標準的品種。
1963年部頒標準收載102種常用藥品,1972年部頒抗生素標準收載17種。1979年部頒放射性藥品、醫用同位素、抗生素等標準,收載43個品種,同時頒發進口藥材標準,收載50個品種。
1983年衛生部進一步加強藥品質量標準制訂工作,全年共頒布部標準119個。1984年全年頒布了甲磺酸酚妥拉明等50個藥品的部標準。]
生物製品規程是國家對生物製品管理、生產和檢定的基本要求。從1977年開始,衛生部對目前生產的各類生物製品的製造及檢定規程進行了系統的整理、修訂、補訂。1979年9月由衛生部批准並頒發的規程共110個。
3.地方藥品標準收載的範圍
(1)中國藥典或部頒標準未收載,可工業生產的,療效肯定或有一定療效,經當地省級衛生行政部門批准的藥品。
(2)藥典和部頒標準未收載,本地區比較常用或外銷的藥材;鞃典或部頒標準已收載但有品種來源未收入而本地區又習慣應用,療效挖的可補充為地方標準。
(3)中藥材飲片、炮製品可逐步制訂標準予以收載。
(4)臨床常用驗方和醫院自製製劑,療效確切的可先制定規程,待工業生產後載入地方標準。
1982年,全國27個省市審批地方藥品標準978個,其中原料藥90種,西藥製劑383種,中藥製劑505種。地方標準的制定在醫藥發展史上曾起過積極的作用,但是,由於各地掌握的審批標準不一,也不可能一致,使得一些新藥有不同的標準;同一種藥物,在甲省不能被批准,在乙省閔可能被批准,長此下去,全國的地方藥品標準勢必出現混亂局面。統一全國地方標準的工作量十分大,但這項工作勢在必行。1986年衛生部提出要逐步取消西藥地方標準,地方習用藥材要先制定地方標準,再逐步取升級,這對統一標準是有益的。
| 關於「醫院藥學/藥學監督的組織網路與職責」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |