醫用化學/緩衝溶液與緩衝作用原理
| 醫學電子書 >> 《醫用化學》 >> PH值與緩衝溶液 >> 緩衝溶液 >> 緩衝溶液與緩衝作用原理 |
| 醫用化學 |
|
|
(一)緩衝作用與緩衝溶液
純水在25℃時PH值為7.0,但只要與空氣接觸一段時間,因為吸收二氧化碳而使PH值降到5.5左右。1滴濃鹽酸(約12.4mol.L-1)加入1升純水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4mol.L-1),若將1滴氫氧化鈉溶液(12.4mol.L-1)加到1升純水中,PH變化也有3個單位。可見純水的PH值因加入少量的強酸或強鹼而發生很大變化。然而,1滴濃鹽酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分(從1.00×10-7增至1.01×10-7mol.L-1),PH值沒有明顯變化.這種能對抗外來少量強酸/強鹼或稍加稀釋不引起溶液PH值發生明顯變化的作用叫做緩衝作用;具有緩衝作用的溶液,叫做緩衝溶液。
(二)緩衝溶液的組成
緩衝溶液由足夠濃度的共軛酸鹼對組成。其中,能對抗外來強鹼的稱為共軛酸,能對抗外來強酸的稱為共軛鹼,這一對共軛酸鹼通常稱為緩衝對、緩衝劑或緩衝系,常見的緩衝對主要有三種類型。
1.弱酸及其對應的鹽 例如,HOAc-NaOAc(實際上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(鄰苯二甲酸-鄰苯二甲酸氫鉀);H3BO3-Na2B4O7(四硼酸鈉水解後產生H2BO-3)。
2.多元弱酸的酸式鹽及其對應的次級鹽,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(檸檬酸二氫鈉)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。
3.弱鹼及其對應的鹽 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其鹽);Tris-TrisH+A-(三羥甲基烷及其鹽)。
(三)緩衝溶液的作用原理
現以HOAc-NaOAc緩衝溶液為例,說明緩衝溶液之所以能抵抗少量強酸或強鹼使PH穩定的原理。醋酸是弱酸,在溶液中的離解度很小,溶液中主要以HOAc分子形式存在,OAc-的濃度很低。醋酸鈉是強電解質,在溶液中全部離解成Na+和OAc-,由於同離子效應,加入NaOAc後使HOAc離解平衡向左移動,使HOAc的離解度減小,[HOAc]增大。所以,在HOAc-NaOAc混合溶液中,存在著大量的HOAc和OAc-。其中HOAc主要來自共軛酸HOAc,OAc-主要來自NaOAc。這個溶液有一定的[H+],即有一定的PH值。
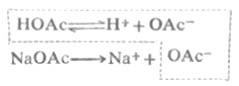
在HOAc-NaOAc緩衝溶液中,存在著如下的化學平衡:
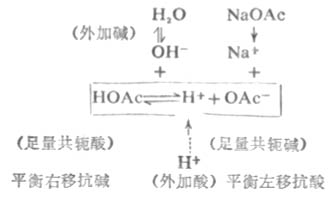
在緩衝溶液中加入少量強酸(如HCL),則增加了溶液的[H+]。假設不發生其他反應,溶液的PH值應該減小。但是由於[H+]增加,抗酸成分即共軛鹼OAc-與增加的H+結合成HOAc,破壞了HOAc原有的離解平衡,使平衡左移即向生成共軛鹼HOAc分子的方向移動,直至建立新的平衡。因為加入H+較少,溶液中OAc-濃度較大,所以加入的H+絕大部分轉變成弱酸HOAc,因此溶液的PH值不發生明顯的降低。
在緩衝溶液中加入少量強鹼(如NaOH),則增加了溶液中OH-的濃度。假設不發生其他反應,溶液的PH值應該增大。但由於溶液中的H+立即加入的OH-結合成更難離解的H2O,這就破壞了HOAc原有的離解平衡,促使HOAc的離解平衡向右移動,即不斷向生成H+和OAc-的方向移動 ,直至加入的OH-絕大部分轉變成H2O,建立新的平衡為止。因為加入的OH-少,溶液中抗鹼成分即共軛酸HOAc的濃度較大,因此溶液的PH值不發生明顯升高。
在溶液稍加稀釋時,其中[H+]雖然降低了,但[OAc-]同時降低了,同離子效應減弱,促使HOAc的離解度增加,所產生的H+可維持溶液的PH值不發生明顯的變化。所以,溶液具有抗酸、抗鹼和抗稀釋作用。
多元酸的酸式鹽及其對應的次級鹽的作用原理與前面討論的相似。例如,在NaH2PO4-Na2HPO4溶液中存在著離解平衡:
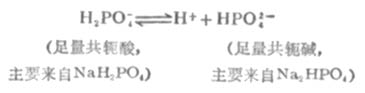
HPO2-4是抗酸成分,通過平衡移能對抗外加酸的影響。H2PO2-4是抗鹼成分,通過平衡右移能對抗外加鹼的影響。
弱鹼及其對應鹽的緩衝作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能對抗外加酸的影響是抗酸成分,NH+4能對抗外加鹼的影響是抗鹼成分。前者通過下述平衡向右移動而抗酸,後者通過平衡向左移動而抗鹼,從而使溶液的PH值穩定。
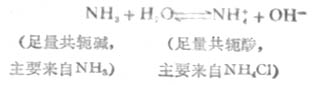
| 關於「醫用化學/緩衝溶液與緩衝作用原理」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |