醫用化學/炔烴
| 醫學電子書 >> 《醫用化學》 >> 鏈烴 >> 炔烴 |
| 醫用化學 |
|
|
炔烴是含有碳碳三鍵(-C≡C-)的鏈烴。
![]()
R-C≡CH或R`-C≡C-R」可代表它們的構造式,碳碳三鍵(-C≡C-)是炔烴的官能團。
炔烴也是不飽和烴,通式是CnH2n-2,與二烯烴或環烯烴相同。
一、炔烴的同分異構現象和命名法
炔烴由於碳鏈構造和三鍵位置的不同,也具有同分異構現象。不過因為三鍵支鏈的位置的限制,其異構體的數目要比碳原子數相同的烯烴為少。例如,含有五個碳原子的炔烴,只有三種同分異構體:
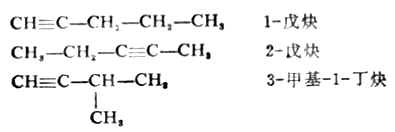
炔烴的命名法和烯烴相似。例如:
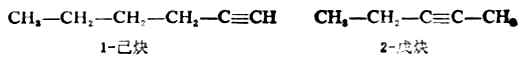
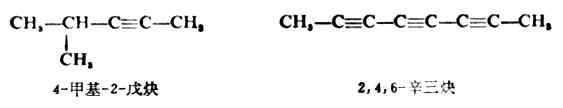
二、炔烴的物理性質
在正炔烴的同系列中,C2~C4的炔烴是氣體,C5~C15的是液體,C15以上的是固體。炔烴的熔點和沸點也隨著碳原子數目的增加而增高(表11-5)。
表11-5炔烴的物理常數
| 名稱 | 構造式 | 熔點/℃ | 沸點/℃ | 相對密度(d204) |
| 乙炔 | HC≡CH | -81.8 | -83.6 | - |
| 丙炔 | CH3C≡CH | -101.51 | -23.2 | - |
| 1-丁炔 | CH3CH2C≡CH | -122.5 | 8.1 | - |
| 2-丁炔 | CH3C≡CCH3 | -32.3 | 27 | 0.691 |
| 1-戊炔 | CH3(CH2)C≡CH | -90 | 29.3 | 0.695 |
| 2-戊炔 | CH3CH2C≡CH | -101 | 55.5 | 0.714 |
| 1-己炔 | CH3(CH2)3C≡CH | -132 | 71 | 0.715 |
| 2-己炔 | CH3(CH2)2C≡CH | -88 | 84 | 0.730 |
| 3-己炔 | CH3CH2C≡CCH3 | -51 | 81.8 | 0.724 |
| 1-庚炔 | CH3(CH2)4C≡CH | -81 | 100 | 0.734 |
| 2-庚炔 | CH3(CH2)3C≡CCH3 | - | 112 | 0.748 |
| 3-庚炔 | CH3(CH2)2C≡CCH3 | - | 105 | 0.752 |
| 1-辛炔 | CH3(CH2)5C≡CH | -80 | 125.2 | 0.746 |
| 2-辛炔 | CH3(CH2)4C≡CCH3 | -60.2 | 137.2 | 0.759 |
| 3-辛炔 | CH3(CH2)C≡CCH2CH3 | -105 | 133 | 0.752 |
| 4-辛炔 | CH3 (CH2) 2C≡C(CH2)2CH3 | -102 | 131 | 0.751 |
| 1-壬炔 | CH3(CH2)6C≡CH | -65 | 160.7 | 0.760 |
| 2-壬炔 | CH3(CH2)5C≡CCH3 | - | 155747 | 0.769 |
| 3-壬炔 | CH3(CH2)4C≡CCH2CH3 | - | 154745 | 0.762 |
| 4-壬炔 | CH3(CH2)3C≡C(CH2)2CH3 | - | 152752 | 0.757 |
| 1-癸炔 | CH3(CH2)7C≡CH | -44 | 0.765 | |
| 3-癸炔 | CH3(CH2)5C≡CCH2CH3 | - | 0.765 |
三、炔烴的化學性質
炔烴的官能團是-C≡C-,它有兩個π鍵,有較弱的親核性(Lewis鹼),其化學性質與烯烴有不少相似之處,例如能發生加成、氧化和聚和反應等。另外,-C≡C-H的C-Hσ鍵具有與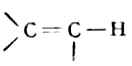
或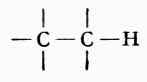
σ鍵不同的性質,即弱酸性很。
(一)加成反應
1.加氫
在催化劑(Pt,Pd或Ni)的作用下,炔烴與氫加成可生成烯烴,最後生成烷烴。
![]()
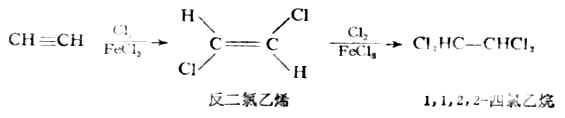
2.加鹵素
炔烴能與氯或溴加成。反應分兩步進行,第一次加1mol試劑,生成烯烴的二鹵衍生物;第二次再加1mol試劑,生成四鹵代烷。例如:
3.加鹵化氫
炔烴和鹵化氫的加成反應也是分兩步進行的。
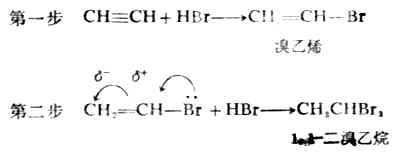
1,1-二溴乙烷
在生成的溴乙烯分子中,溴原子的未共用電子對與π鍵形成共軛體系(p-π共軛),這裡共軛效應起了主要作用,而溴原子的誘導效應僅居次要地位。因此,當與第二個溴化氫分子加成時,溴原子繼續加在已有一個溴的碳原子上,生成CH3CHBr2。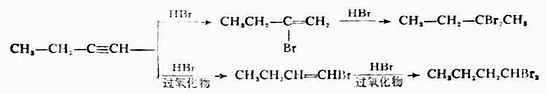
不對稱炔烴與HX加成時遵從馬氏規則。在有過氧化物存在下,不對稱炔烴與HBr的加成反應則是反馬氏規則的。
(二)氧化反應
炔烴氧化時,碳鏈在三鍵處斷裂。例如,乙炔用高錳酸鉀氧化時,生成二氧化碳。
![]()
其它炔烴用高錳酸鉀氧化,生成羧酸。
![]()
從反應結果可以看到高錳酸鉀的紫色消失,所以也可利用此反應檢查碳碳三鍵。
(三)聚合反應
乙炔在不同的催化劑和反應條件下,發生各種不同的聚合反應,生成鏈狀或環狀的化合物。如乙炔若發生二分子聚合反應時,生成乙烯基乙炔CH2=CH-C≡CH;若在適當的催化劑存在下,三個分子的乙炔聚合成苯。

(四)炔化物的生成
連接在C≡C碳原子上的氫原子相當活潑,這是因為三鍵C是sp雜化,s成分佔1/2,電負性比較強,使得Csp-H1sσ鍵的電子云更靠近碳原子,增強了C-H鍵極性,使氫原子容易離解,顯示酸性。乙炔基陰離子能量低,體系穩定,所以乙炔分子CH≡CH中氫原子容易被金屬取代,生成的炔烴金屬衍生物叫做炔化物。例如,將乙炔通入硝酸銀氨溶液或氯化亞銅氨溶液中,分別生成白色的乙炔銀和磚紅色的乙炔亞銅沉澱。
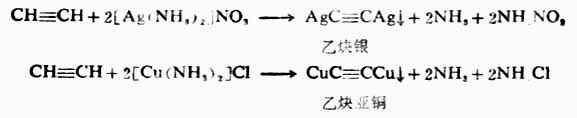
上述反應極為靈敏,常用來鑒定具有-C≡CH構造特徵的炔烴,並可利用這一反應從混合物中把這種炔烴分離出來。而R`-C≡C-R型的炔烴不發生這兩個反應。乙炔銀和乙炔亞銅在濕潤時比較穩定,在乾燥時能因撞擊或升高溫度發生爆炸,所以實驗完畢後,應立即加硝酸把它分解掉。
| 關於「醫用化學/炔烴」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |