氫氧化鈣
| A+醫學百科 >> 氫氧化鈣 |
目錄 |
簡介
產品名稱: 氫氧化鈣
顏色:白色粉末狀固體.
溶解性:微溶於水。
產品英文名 Calcium hydroxide;Hydrated lime;Slaked lime;Lime,hydrated,limewater
產品別名: 消石灰 ; 熟石灰
分子式 :Ca(OH)2
製備方法:CaO+H2O=Ca(OH)2
產品用途
用於制漂白粉, 檢驗CO2氣體,硬水軟化劑,改良土壤酸性,自來水消毒澄清劑及建築工業等
毒性防護
其粉塵或懸浮液滴對粘膜有刺激作用,能引起噴嚏和咳嗽,和鹼一樣能使脂肪乳化,從皮膚吸收水分、溶解蛋白質、刺激及腐蝕組織。吸入石灰粉塵可能引起肺炎。 最高容許濃度為5mg/m3。 吸入粉塵時,可吸入水蒸氣、可待因及猶奧寧,在胸廓處塗芥末膏;當落入眼內時,可用流水儘快沖洗,再用5%氯化銨溶液或0.01%CaNa2-EDTA溶液沖洗,然後將0.5%地卡因溶液滴入。工作時應注意保護呼吸器官,穿戴用防塵纖維制的工作服、手套、密閉防塵眼鏡,並塗含油脂的軟膏,以防止粉塵吸入。
包裝儲運
用內襯聚乙烯塑料薄膜袋的塑料編織袋包裝,每袋淨重25kg。應貯存在乾燥的庫房中。嚴防潮濕。避免與酸類物質共貯混運。運輸時要防雨淋。失火時,可用水,砂土或一般滅火器撲救。
物化性質
細膩的白色粉末。相對密度2.24。加熱至580℃脫水成氧化鈣,在空氣中吸收二氧化碳而成碳酸鈣。溶於酸、銨鹽、甘油,微溶於水,不溶於醇,有強鹼性,對皮膚、織物有腐蝕作用。
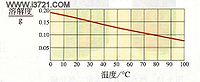
水中溶解度
0℃ 0.18g
10℃0.17g
20℃0.16g
30℃0.15g
40℃0.14g
50℃0.13g
60℃0.12g
70℃0.105g
80℃0.095g
90℃0.08g
100℃0.07g
質量標準 美國軍用標準 O-C-110C (1984)
分子量 74.09
結構式 Ca(OH)2
消耗定額 石灰消化法
石灰石 (CaCO3 98%) 1.35
焦炭 0.18
其他相關
日本 石灰消化法
生石灰 (CaO 100%) 0.840
專業法定編號
製備方法
國際儲運號
主要化學方程式有:
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓,這個反應可以用來製取小量燒鹼。
氫氧化鈣和二氧化碳的反應
Ca(OH)2+CO2=CaCO3↓+H2O(這是石灰漿塗到牆上後氫氧化鈣與二氧化碳發生的反應,牆會「冒汗」就是因為生成了水H2O,牆變得堅固是因為生成了碳酸鈣CaCO3,在鄉下有時為了使牆更快變硬,就在剛刷好的屋裡燒炭生成二氧化碳CO2(C+O2=(點燃)CO2)。這個反應也是檢驗CO2的方程式,氣體通入石灰水變混濁的是CO2)。
氫氧化鈣和二氧化碳的反應可用於*初中階段*檢驗CO2
Ca(OH)2+CO2=CaCO3↓+H2O
但如果CO2過量沉澱會溶解
CaCO3+CO2+H2O=Ca(HCO3)2 ---------Ca(HCO3)2(碳酸氫鈣易溶於水)
不同量的氫氧化鈣和碳酸氫鈉的反應
2NaHCO3+Ca(OH)2(少量)=CaCO3↓+2H2O+Na2CO3
NaHCO3+Ca(OH)2(過量)=CaCO3↓+H2O+NaOH
工業上煅燒石灰石CaCO3==(高溫)CaO+CO2↑(此反應也是工業上製取大量CO2的方法,一式二用)
工地上經常冒白煙是在制石灰漿Ca(OH)2:CaO+H2O=Ca(OH)2(因為熟石灰的溶解度隨溫度升高而降低,所以工人更願意在夏天制石灰漿,這樣溫度高時溶進水的熟石灰少,可製得更多石灰漿,此反應放出大量熱量)
石灰漿(石灰漿,熟石灰即Ca(OH)2)被抹在牆上,與CO2反應後變硬Ca(OH)2+CO2=CaCO3↓+H2O
氟化氫氨與氫氧化鈣的化學方程式:NH4HF2 + Ca(OH)2 = CaF2 + 2H2O +NH3
氯化鎂和氫氧化鈣反映的化學方程式:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓
硝酸氨與氫氧化鈣反應的化學方程式:
2NH4NO3+Ca(OH)2=NH3↑+H2O+Ca(NO3)2
(NH4)2SO4+Ca(OH)2=NH3↑+H2O+CaSO4
CaCO3+SiO2=CaSiO3+CO2 條件是高溫
氫氧化鈣具有鹼的通性,是一種強鹼。氫氧化鈣的鹼性比氫氧化鈉強(金屬活動性鈣>鈉),但由於氫氧化鈣的溶解度比氫氧化鈉小得多,所以氫氧化鈣溶液的腐蝕性和鹼性比氫氧化鈉小。這些性質決定了氫氧化鈣有廣泛的應用。農業上用它降低土壤酸性,改良土壤結構,很明顯在這種場合用氫氧化鈉是不可能的。農藥波爾多液是用石灰乳和硫酸銅水溶液按一定比例配製的。因1885年首先用於法國波爾多城而得名。這種用於果樹和蔬菜的天藍色粘稠的懸濁液農藥,是通過其中的銅元素來消滅病蟲害的。其中不僅利用了氫氧化鈣能與硫酸銅反應的性質,也利用了氫氧化鈣微溶於水的特點使藥液成粘稠性,有利於藥液在植物枝葉上附著。另外氫氧化鈣與空氣中的二氧化碳反應生成難溶於水的碳酸鈣,也有利於藥液附著於植物表面一段時間不被雨水衝掉。
氫氧化鈣和二氧化碳的反應不論在化學實驗室還是在工農業生產中,或者在自然界都經常發生。經常被利用著。石灰沙漿砌磚抹牆的事實熟為人知。鮮為人知的是製糖工業中也發生這個反應:在製糖過程中要用氫氧化鈣來中和糖漿里的酸,然後再通入二氧化碳使剩餘的氫氧化鈣變成沉澱過濾出去,這樣才能減少糖的酸味。
氫氧化鈣溶液和飽和碳酸鈉溶液反應能夠生成氫氧化鈉:
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓,這個反應可以用來製取小量燒鹼。
Ca(OH)2+CO2=CaCO3↓+H2O ,這個反應可用來鑒定氫氧化鈣溶液。
如果在氫氧化鈣溶液中繼續通入二氧化碳,會發下溶液先渾濁後澄清,這是因為二氧化碳會和碳酸鈣[Ca(CO3)]繼續反應
CaCO3+CO2+H2O=Ca(HCO3)2, 而碳酸氫鈣[Ca(HCO3)2]是易溶的,所以溶液會再次澄清。加熱溶液又變渾濁,因為碳酸氫鈣受熱分解
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
氫氧化鈣不能盛放在帶玻璃塞的試劑瓶中,因為雖然二氧化矽化學性質穩定,但是會與強鹼反應,如NaOH,KOH,RbOH,Ba(OH)2,Ca(OH)2。如果把氫氧化鈣
放在帶玻璃塞的試劑瓶中,會發生如下反應:
Ca(OH)2+SiO2===CaSiO3↓+H2O
而矽酸鈣會沉澱在瓶塞上,導致瓶子打不開,所以不能盛放在帶玻璃塞的試劑瓶中。
製取氫氧化鈣:H2O+CaO=Ca(OH)2(這裡切記!沒有沉澱符號的)
初中需掌握的並不多:
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓
Ca(OH)2+2HCl=CaCl2+2H2O
| 關於「氫氧化鈣」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |