糖原磷酸化酶(英語:Glycogen phosphorylase;EC 2.4.1.1)是糖原分解代謝中的關鍵酶,催化糖原的磷酸解反應。
概述
糖原磷酸化酶催化的糖原分解反應底物為糖原和無機磷酸,產物為葡糖-1-磷酸和少一葡糖單位的糖原,反應總是從糖原的非還原端開始。雖然這一反應的標準自由能變化為正值,但由於細胞內無機磷酸的濃度遠遠超過葡糖-1-磷酸的濃度,因此此分解反應可以順利進行。
糖原磷酸化酶只能打斷某些α(1→4)糖苷鍵,並不能作用糖原分子分支部分的α(1→6)糖苷鍵。而且,對於與分支點相距三個葡糖殘基的α(1→4)糖苷鍵,糖原磷酸化酶同樣是無能為力,這些糖苷鍵只有藉助脫支酶才能水解。
糖原磷酸化酶在哺乳動物中主要存在三種同工酶:肌型、肝型和腦型。
結構
糖原磷酸化酶由兩個完全相同的97k亞基組成,每一個亞基與一分子磷酸吡哆醛輔基通過亞胺的形式共價結合,具N端(1~484aa)和C端(484~842aa)兩個結構域。磷酸吡哆醛的作用不明,有研究顯示用硼氫化鈉將其亞胺結構還原對酶的活性亦沒有影響,所以一般認為只有其上相連的磷酸基團行使催化作用,而與吡哆醛無關。
糖原磷酸化酶的催化過程起始於處於磷酸吡哆醛與糖原之間的無機磷酸,它貢獻一個質子給將要斷裂的非還原端葡糖殘基,使之形成半椅型的氧正離子中間體,然後該中間體被磷酸根離子進攻,從而產生葡糖-1-磷酸。整個過程中酶的磷酸吡哆醛輔基行廣義酸鹼催化,負責向反應進程中的磷酸根離子提供或奪取質子。 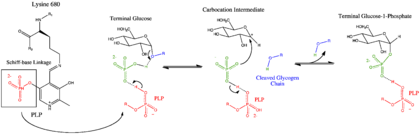
調節
糖原磷酸化酶的活性受到別構效應物和共價修飾的調節,不過對於糖原磷酸化酶的各種同功酶,受功能和結構上差異的影響,其調節機制事實上不盡相同。
外部連結
參考來源
更多醫學百科條目
