生理學/生物電現象的產生機制
| 醫學電子書 >> 《生理學》 >> 細胞的基本功能 >> 細胞的興奮性和生物電現象 >> 細胞的生物電現象及其產生機制 >> 生物電現象的產生機制 |
| 生理學 |
|
|
|
早在1902年,Bernstein就提出膜學說,他根據當時關於電離和電化學的理論成果提出了經典的膜學說來解釋當時用粗劣的電測量儀器記錄到的生物電現象。他認為細胞表面膜兩側帶電離子的不同分布和運動,是產生物電的基礎。但在當時和以後相當長的一段時期內,還沒有測量單一細胞電活動的手段和其他有關技術,因此他的學說長期未能得到證實。直到本世紀40~50年代,Hodgkin 和Huxley等開始利用槍烏賊的巨大神經軸突和電生理學技術,進行了一系列有意義的實驗,不僅對經典膜學說關於靜息電位產生機制的假設予以證實,而且對動作電位的產生作了新的解釋和論證。通過這一時期的研究,對於可興奮細胞靜息電位和動作電位的最一般原理已得到闡明,即細胞生物電現象的各種表現,主要是由於某些帶電離子在細胞膜兩側的不均衡分布,以及膜在不同情況下對這些離子的通透性發生改變所造成的。但是由於當時對細胞膜的分子結構和膜中蛋白質的存在形式和功能還知之甚少,因此Hodgkin等對生物電的理解只能是宏觀的,對微細過程只能用數學模型來說明。隨著70年代以來蛋白質化學和分子生物學技術的迅速發展,蛋白質分子從膜結構中克隆出來,並從它們的分子結構的特點來說明通道的功能特性;特別是70年代中期發展起來的膜片鉗(patch clamp)技術,可以觀察和記錄單個離子通道的功能活動,使宏觀的所謂膜對離子通透性或膜電導的改變,得到了物質的、可測算的證明。
1.靜息電位和K+平衡電位 Bernstein最先提出,細胞內外鉀離子的不均衡分布和安靜狀態下細胞膜主要對K+有通透性,可能是使細胞能保持內負外正的極化狀態的基礎。已知所有正常生物細胞細胞內的K+濃度超過細胞外K+很多,而細胞外Na+濃度超過細胞內Na+濃度很多,這是Na+泵活動的結果;在這種情況下,K+必然會有一個向膜外擴散的趨勢,而Na+有一個向膜內擴散趨勢。假定膜在安靜狀態下只對K+有通透的可能,那麼只能有K+移出膜外,這時又由於膜內帶負電荷的蛋白質大分子不能隨之移出細胞,於是隨著K+移出,出現膜內變負而膜外變得較正的狀態。K+的這種外向擴散並不能無限制地進行,這是因為移到膜外的K+所造成的外正內負的電場力,將對K+的繼續外移起阻礙作用,而且K+移出的愈多,這種阻礙也會愈大。因此設想,當促使K+外移的膜兩側K+濃度勢能差同已移出K+造成的阻礙K+外移的電勢能差相等,亦即膜兩側的電-化學(濃度)勢代數和為零時,將不會再有K+的跨膜淨移動,而由已移出的K+形成的膜內外電位差,也穩定在某一不再增大的數值。這一穩定的電位差在類似的人工膜物理模型中稱為K+平衡電位。Bernstein用這一原理說明細胞跨膜靜息電位的產生機制。不難理解,K+平衡電位所能達到的數值,是由膜兩側原初存在K+濃度差的大小決定的,它的精確數值可根據物理化學上著名的Nernst公式(1889)算出:
![]() (1)
(1)
(1)式中Ek表示K+平衡電位,R是通用氣體常數,Z是離子價,F是Farady常數,T是絕對溫度;式中只有[K+]o和[K+]i是變數,分別代表膜兩側的K+濃度。如果把有關數值代入,室溫以27°С計算,再把自然對數化為常用對數,則式(1)可簡化為;(2)
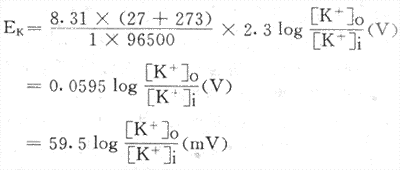 (2)
(2)
如果,Bernstein應用當時物理化學最新成果說明細胞靜息電位產生機制的理論是正確的,那麼在細胞實際測得的靜息電位的數值,應相當於把當時細胞內外K+濃度值代入式(2)時計算所得的Ek值。1939年Hodgkin等利用了槍烏賊的巨大神經纖維和較精密的示波器等測量儀器,第一次精確地測出此標本的靜息電位值,結果發現此值和計算所得的K+平衡電位值非常接近而略小於後者;如在一次實驗中測得的靜息電位值為-77mV,而按當時[K+]o和[K+]i值算出的Ek為-87mV,基本上符合膜學說關於靜息電位產生機制的解釋。
為了進一步證實這一理論,Hodgkin等又用人工地改變標本浸溶液中K+濃度即[K+]o,因而也改變了[K+] o/[K+] i值的實驗方法,觀察到所記錄的靜息電位的什也隨[K+]o的改變而改變,而改變的情況基本上同根據式(2)計算出的預期值相一致。隨後用微電極細胞內記錄法在纖細的哺乳類標本也進行了類似的實驗,得到類似的結果,如在骨骼肌細胞測得的靜息電位為-90mV,而計算所得的Ek值為-95mV。這些實驗都說明,大多數細胞的靜息電位的產生,是由於正常細胞的細胞內液高K+而膜在安靜時又主要對K+有通透能力的結果;至於靜息電位的數值為何略小於理論上的Ek值,一般認為是由於膜在靜息時對Na+也有極小的通透性(大約只有K+通透性的1/50~1/100)的緣故;由於膜外Na+濃度大於膜內,即使小量的Na+逸入膜內也會抵消一部分K+外移造成的膜內負電位。
2.鋒電位和Na+平衡電位 Hodgkin等根據興奮時膜內不僅出現負電位的消失,而且出現一定數值的正電位(相當於前面提到的超射值)的事實,因而認為對動作電位上升支的出現,不能像Bernstein那樣簡單地解釋為膜對K+通透性的消失,因為這樣最多也只能使膜內原有的負電位回升到零。他們據此設想膜在受到刺激時可能出現了膜對Na+通透性的突然增大,超過了K+的通透性,由於細胞外高Na+,而且膜內靜息時原已維持著的負電位也對Na+的內流起吸引作用,於是Na+迅速內流,結果先是造成膜內負電位的迅速消失;而且由於膜外Na+的較高的濃度勢能,Na+在膜內負電位減小到零電位時仍可繼續內移,直至內移的Na+在膜內形成的正電位足以阻止Na+的淨移入時為止。不難設想,這時膜內所具有的電位值,理論上應相當於根據膜內外Na+濃度差代入Nernst公式時所得出的Na+平衡電位值(可寫為ENa)。實驗數據證明,動作電位所能達到的超射值,即膜內正電位的數值,正相當於計算所得的ENa;而且實驗中隨著標本浸溶液中Na+被同等數目的葡萄糖分子所代替(使[Na+]o逐漸減小),可以看到所能記錄到的動作電位的超射值和整個動作電位的幅度也逐漸減小,其程度也同按Nernst公式算出的預期值基本一致。
但是,膜內電位停留在ENa水平的時間極短;隨後很快出現膜內電位向靜息時的狀態恢復,亦即出現復極,造成了鋒電位曲線的快速下降支。如後來的實驗證明,這下降支的出現是由於Na+通透性的消失,並伴隨出現了K+通透性的增大。
細胞每興奮一次或產生一次動作電位,總有一部分Na+在去極化時進入膜內,一部分K+在復極時逸出膜外,但由於離子移動受到各該離子的平衡電位的限制,它們的實際進出量是很小的;據估計,神經纖維每興奮一次,進入膜內的Na+量大約只能使膜內的Na+濃度增大約八萬分,復極時逸出的K+量也類似這個數量級;即便神經連續多次產生興奮,短時間內也不大可能明顯地改變膜內高K+和膜外高Na+這種基本狀態,而只要這種不均衡離子分布還能維持,靜息電位就可以維持,新的興奮就可能產生。細胞膜兩側K+、Na+離子的不均衡分布,主要是靠鈉泵蛋白質消耗代謝能建立起來的,而由此形成的勢能貯備卻可供細胞多次產生興奮而不需當時耗氧供能。不過實際上鈉泵的活動又受膜內外Na+、K+濃度的調控,它對膜內Na+濃度增加十分敏感,Na+的輕微增加就能促使鈉泵的活動,因此在每次興奮後的靜息期內,都有鈉泵活動的一定程度的增強,將興奮時多進入膜內的Na+泵出,同時也將復極時逸出膜外的K+泵入,使興奮前原有的離子分布狀態得以恢復。這時由於兩種離子的轉運同時進行,出入的離子總數又近於相等,故一般不伴有膜兩側電位的明顯改變。但在膜內Na+蓄積過多而使鈉泵的活動過度增強時,上述的定比關係可以改變,結果是泵出的Na+量有可能明顯超過泵入的K+量,這就可能使膜內負電荷相對增多,使膜兩側電位向超極化的方向變化;這時的鈉泵,就稱為生電性鈉泵。有人認為,鋒電位以後出現的正後電位,是由於生電性鈉泵作用的結果。至於負後電位,則一般認為是在復極時迅速外流的K+蓄積在膜外側附近,因而暫時阻礙了K+外流的結果。
3.經典的電壓鉗(或電壓固定)實驗 從上述可知,Hodgkin等對於動作電位產生機制的說明,關鍵在於膜受刺激時對Na+、K+的通透性發生了有選擇而時間亦有先後的改變,但這只是根據所測得的膜內外電位改變對照Nernst公式進行的推論,實驗並沒有對膜的通透性進行直接的測量和動態描述。為此,他們又應有當時最先進的電子學技術,設計和進行了著名的電壓鉗(voltage clamp)實驗。實驗的設計根據是:離子作跨膜移動時形成了跨膜離子電流(I),而通透性亦即離子通過膜的難易程度,就是膜的電阻(R)或其倒數電導(G),因此所謂膜對某種離子通透性增大時,實際是膜對該離子的電導加大;對於帶電離子來說,膜電導就是膜通透性的同義語。根據歐姆定律,I=VG,可知在膜兩側電位差(V)固定不變的條件下,測出的跨膜電流I的變化,就可作為膜電導變化的度量。測定膜在受刺激時跨膜電流的改變在技術上是容易的,但在這過程中要保持膜電位固定不變卻不容易;因為當存在跨膜離子電流時,離子的進出膜會使不導電而有電容(C)特性的脂質膜充電或放電,因而根據V=Q/C的關係(其中Q為電量,相當於I和時間t的乘積),跨膜離子的移動必然要引起跨膜電位的改變;實際上記錄到的動作電位就是這種改變。正因為如此,Hodgkin等自行設計了一種應用負反饋原理的電子學裝置,使它們能在跨膜電位維持恆定(恆定的數值可由實驗者通過實驗裝置預先設定)的情況下,測量跨膜離子電流的強度改變,並由此計算出膜電導即膜通透性的變化情況。電壓鉗實驗的基本原理模式圖如圖2-12所示。圖中電極1插入巨大神經軸突內一定距離,用來測量和監察這一段軸突膜內的電位,此電極先連到一個電壓放大器,再在一個示波器上顯示;電極1測得電位值經放大後同時輸給一個負反饋放大器(FBA),這是整個儀器設計的關鍵部分,它可把測得的膜內電位同來自一個電壓源的、由實驗者預先設定的要求保持恆定的電位值進行比較,如果二者有差值,FBA就會通過電極2向軸突膜內輸出相應強度和方向的電流,由於儀器線路的精密設計和快速反應,電極2輸出電流的改變正足以補償標本由於跨膜離子電流使膜充放電而引起的跨膜電位的變動,於是與電極1相邊的示波器上顯示出膜內電位固定在設定的數值,而在電流放大器IA上測得的跨膜離子電流的變化,就反映了膜電導的變化。
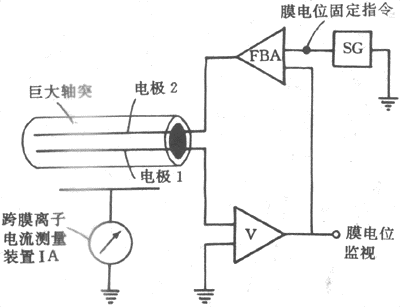
圖 2-12 電壓鉗實驗布置模式圖
電壓固定實驗獲得了許多有意義的結論。首先一點是,只有設定的膜內電位固定在去極化水平時,才有可能出現膜的Na+電導(GNa)和K+電導(Gk)的增大,並且設定電位愈接近零值,電導的增大也愈明顯;相反,如果設定的膜內電位值是超極化的,則不可能引起跨膜離子電流和膜電導的改變,這一點以後還要談到。以圖2-13的記錄曲線為例,分析不同離子的電導在一次興奮過程中的變化情況。圖中最上方曲線表示在一次電壓鉗實驗中,把膜內電位由靜息時的-65mV突然固定(這就是(clamp)的意思)在-9mV,結果很快引起一次如曲線A的跨膜電流變化曲線,這曲線的開始部分是內向的,以後逐漸轉變為外向電流。只記錄到內向或外向電流還不能說明電荷的攜帶者是何種離子,根據過去的實驗者有理由認為,先出現的內向電流可能是Na+電流(INa),外向電流則可能是K+電流(Ik)。用附加的實驗觀察證明了這點:假定把標本浸浴液中的NaCI用相同摩爾數的氯化膽鹼來代替,則在同樣的條件下只能記錄到較晚出現的曲線B,它是外向的,這顯然是因為不能出現內向的INa的結果;把曲線A和B逐點相減,就能得到曲線C,它就是內向的INa;由INa、Ik兩條曲線,就可算出GNa和Gk的變化曲線,其特點是:(1)GNa和Gk都是電壓依從性的,只能由跨膜電位的去極化所激活,但GNa被激活得早,是動作電位上升支出現的基礎,而Gk激活出現緩慢,是動作電位復極到靜息電位水平的基礎;(2)GNa有失活(inactivation)狀態而Gk沒有此特性,其證明是圖2-13中曲線C只存在1~2ms,以後跨膜電壓雖仍固定在-9mV的水平,但GNa早已恢復到原初水平,而代表Gk的曲線B雖然出現較晚,但它在設定電位持續期間一直維持在較同的水平。GNa失活的出現和Gk的激活是造成神經纖維和骨骼肌細胞表現短促的鋒電位的原因;在膜復極以後GNa的失活狀態才能消失,這時GNa才能因膜的去極化而再出現增大。
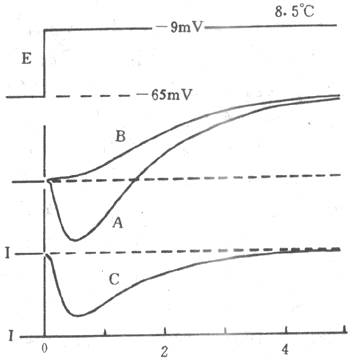
圖2-13 電壓鉗實驗結果示意圖
將巨大神經纖維的膜電位由原來的-65mv突然上升並固定於-9mv的水平時,
膜的離子電流的變化情況(曲線A、B、C的意義見正文)
根據圖2-13中INa和Ik兩條電流曲線,即可計算出同這兩者相對應的GNa和Gk曲線,再根據這一段膜所具有的電容的數值(有人測得每cm2的槍烏賊軸突膜的電容約為1μF),就可算出如果「允許」每一瞬間的離子移動在電容上形成電位改變時,有可能造成怎樣的跨膜電位的改變,這正是不進行「電壓固定」時的情況,而由此作出的電位變化曲線正好同在一般實驗中記錄到的動作電位的波形特點一致,如圖2-14所示。這進一步說明了電壓鉗實驗證明動作電位產生機制的正確性。
4.膜片鉗實驗和單通道離子電流的記錄通過上節關於電壓門控通道的特性分析已知,所謂膜對某種離子通透性的改變,實際上決定於膜結構中有關離子通道蛋白質分子的功能狀態;例如,Hodgkin等測出的GNa的變化,實際是那一段軸突膜上眾多的電壓門控式Na+通道因膜的去極化而開放的結果。在Hodgkin等當時進行的膜電導改變的數學模擬中,已經明確提示,GNa和Gk的改變不是均勻地發生在整個膜平面上,而是與膜上某些特定的「點」有關,不久又發現,有些藥物可以選擇性地阻斷某種離子的跨膜移動,如河豚毒可以單獨阻斷GNa而不影響Gk,四乙基銨可以單獨阻斷Gk而不影響GNa;以同位素標記的河豚毒只能與膜上某些特殊的「點」作特異性結合,而標記的四乙基銨只能與另一些「點」結合。這些實驗以及興奮過程中離子移動數目之多與快,逐漸使人們推斷膜結構中有特殊的蛋白質離子通道的存在。這說明,「通道」概念的提出,遠在通道的實質被闡明以前,是前者促進了對後者的進一步探索。70年代中期由Neher和Sakmann等發展出一種能夠記錄膜結構中單一的離子通道蛋白質分子的開放和關閉、亦即測量單通道離子電流和電導的技術,稱為膜片鉗實驗。
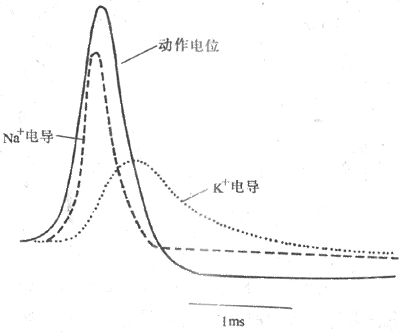
圖 2-14 電導變化與電位變化的關係示意圖
根據電壓鉗實驗中測得的Na+電導(GNa)和K+電導(Gk)的變化過程,
可以算出在膜電位不進行人為固定時,相應的Na+、K+離子電流在膜電容
上引起的電位變化(實線),其形狀正同在標本上記錄到的動作電位的波形一致
膜片鉗實驗的基本原理如圖2-15A所示:用一個尖端光潔、直徑約0.5~3μm的玻璃微電極同神經或肌細胞的膜接觸而不刺入,然後在微電極另一端開口施加適當的負壓,將與電極尖端接觸的那一小片膜輕度吸入電極尖端的纖細開口,這樣在這小片膜周邊與微電極開口處的玻璃邊沿之間,會形成緊密的封接,在理想的情況下其電阻可達數個或數十千兆歐(其物理過程目前尚不清楚),這實際上把吸附在微電極尖端開口處的那一小片膜同其餘部分的膜在電學上完全隔離開來;如果在這一小片膜中只包含了一個或少數幾個通道蛋白質分子,那麼通過此微電極就可能測量出單一通道開放時的離子電流和電導,並能對單通道的其他功能特性進行分析。

圖2-15 膜片鉗實驗布置示意圖
A:圖中Ip為記錄到的單通道電流,VCMD決定設定的膜電位數值
離子電流,強度為pA(皮安)級
從Neher等最初用膜片鉗技術觀察骨骼肌終板膜處的單一ACh-門控通道機能特性開始,已經對多種通道進行了觀察,發現它們一般有如下共同特性:(1)不論是化學門控或電壓門控通道,它們的開放和關閉都是突然的,使描繪出的電流曲線呈方波狀,說明相應的蛋白質分子可以從一種構象快速地躍變到另一種構象;(2)每種通道開放時具有恆定的電導,即在恆定的情況下,只能看到「開」或「關」兩種狀態,很少看到「半開」或「部分開」的情況;(3)即使是同一通道分子,每次開放的持續時間長短也不一致,似乎說明蛋白質分子可在開放和關閉兩種構象之間「擺動」,停留在某種狀態的長短具有隨機的性質;(4)在化學門控通道結合了相應的化學信號分子,或電壓門控通道所在膜兩側處於特定的電位差的情況下,「擺動」的次數增多,開放的機率增大,而「失活」使開放的機率減小。
用單通道記錄可說明在自然情況下整段膜的離子電導和離子電流的形成機制;以上述GNa增大為例,它顯然是該段膜中眾多的Na+通道在去極化的影響下出現開放的機率增加所決定的,而在每一瞬間同時出現的各通道的電導或離子電流相互疊加,於是如圖2-16B所示,這種疊加形成的Na+電流曲線,正好和圖2-13中的曲線C相似。
膜片鉗實驗可用於各種細胞,由於微電極不刺入細胞,即使用於纖小的細胞也不致造成損傷。膜片鉗實驗已有各種變式,如吸著在微電極尖端的小膜片可以隨電極而同原細胞脫離,把它們浸入人工浸浴液中,就可以觀察某些因素在膜的胞漿側怎樣影響通道功能;也可以形成膜的胞漿側面向微電極尖端開口而膜表面側面向浸浴液的實驗模式,等等。膜片鉗實驗也已用於細胞生物電以外的功能研究,如細胞的分泌過程等。
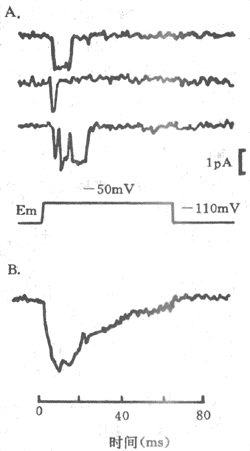
圖2-16 電壓門控Na+通道的膜片鉗記錄A:
隨著靜息電位(Em)由-110mV突然固定到-50mV,
在3次膜片鉗實驗記錄到的離子電流 B:將144次膜片鉗記錄
到的離子電流曲線進行平均疊加,得到一條類似圖
2-13中曲線C的Na+電流曲線,說明後者是多數Na+通道激活的結果
| 關於「生理學/生物電現象的產生機制」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |