生物化學與分子生物學/變構酶
| 醫學電子書 >> 《生物化學與分子生物學》 >> 酶 >> 酶在體內存在的幾種主要形式 >> 變構酶 |
| 生物化學與分子生物學 |
|
|
1.概念
有些酶除了活性中心外,還有一個或幾個部位,當特異性分子非共價地結合到這些部位時,可改變酶的構象,進而改變酶的活性,酶的這種調節作用稱為變構調節(allosteric regulation),受變構調節的酶稱變構酶(allostericenzyme),這些特異性分子稱為效應劑(effector)。變構酶分子組成,一般是多亞基的,分子中凡與底物分子相結合的部位稱為催化部位(catalytic site),凡與效應劑相結合的部位稱為調節部位(regulatorysite),這二部位可以在不同的亞基上,或者位於同一亞基。
2.機理
(1)一般變構酶分子上有二個以上的底物結合位點。當底物與一個亞基上的活性中心結合後,通過構象的改變,可增強其他亞基的活性中心與底物的結合,出現正協同效應(positivecooperative effect)。使其底物濃度曲線呈S形。即底物濃度低時,酶活性的增加較慢,底物濃度高到一定程度後,酶活性顯著加強,最終達到最大值Vmax(圖2-20)。
多數情況下,底物對其變構酶的作用都表現正協同效應,但有時,一個底物與一個亞基的活性中心結合後,可降低其他亞基的活性中心與底物的結合,表現負協同效應(negative cooperative effect)。如3-磷酸甘油醛脫氫酶對NAD+的結合為負協同效應。
(2)變構酶除活性中心外,存在著能與效應劑作用的亞基或部位,稱調節亞基(或部位),效應劑與調節亞基以非共價鍵特異結合,可以改變調節亞基的構象,進而改變催化亞基的構象,從而改變酶活性。凡使酶活性增強的效應劑稱變構激活劑(allosteric activitor),它能使上述S型曲線左移,飽和量的變構激活劑可將S形曲線轉變為矩形雙曲線(圖2?0)。凡使酶活性減弱的效應劑稱變構抑制劑(allosteric inhibitor),能使S形曲線右移。例如,ATP是磷酸果糖激酶的變構抑制劑,而ADP、AMP為其變構激活劑。
(3)由於變構酶動力學不符合米-曼氏酶的動力學,所以當反應速度達到最大速度一半時的底物的濃度,不能用Km表示,而代之以K0.55表示(圖2-20)。為了解釋變構酶協同效應的機制並推導出動力學曲線方程式,不少人曾提出各種模型,各有優缺點,現將有關變構作用的Hill模式內容附本章節後,供學習參考。
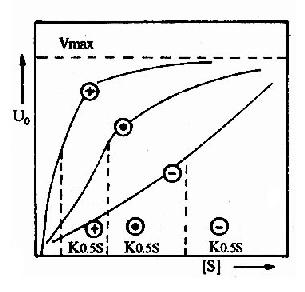
圖2-20 變構酶的底物活性曲線
⊙不加變構劑![]() 加變構抑制劑
加變構抑制劑
3.生理意義
(1)在變構酶的S形曲線中段,底物濃度稍有降低,酶的活性明顯下降,多酶體系催化的代謝通路可因此而被關閉;反之,底物濃度稍有升高,則酶活性迅速上升,代謝通路又被打開,因此可以快速調節細胞內底物濃度和代謝速度。
(2)變構抑制劑常是代謝通路的終產物,變構酶常處於代謝通路的開端,通過反饋抑制,可以及早地調節整個代謝通路,減少不必要的底物消耗。
例如葡萄糖的氧化分解可提供能量使AMP、ADP轉變成ATP,當ATP過多時,通過變構調節酶的活性,可限制葡萄糖的分解,而ADP、AMP增多時,則可促進糖的分解。隨時調節ATP/ADP的水平,可以維持細胞內能量的正常供應。
參看
| 關於「生物化學與分子生物學/變構酶」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |