毛細管電泳
| A+醫學百科 >> 毛細管電泳 |
毛細管電泳(capillary electrophoresis, CE)又叫高效毛細管電泳(HPCE), 是近年來發展最快的分析方法之一。1981年Jorgenson和Lukacs首先提出在75μm內徑毛細管柱內用高電壓進行分離, 創立了現代毛細管電泳。1984年Terabe等建立了膠束毛細管電動力學色譜。1987年Hjerten 建立了毛細管等電聚焦, Cohen和Karger提出了毛細管凝膠電泳。1988~1989年出現了第一批毛細管電泳商品儀器。短短几年內, 由於CE符合了以生物工程為代表的生命科學各領域中對多肽、蛋白質(包括酶,抗體)、核苷酸乃至脫氧核糖核酸(DNA)的分離分析要求, 得到了迅速的發展。
CE是經典電泳技術和現代微柱分離相結合的產物。CE和高效液相色譜法(HPLC)相比, 其相同處在於都是高效分離技術, 儀器操作均可自動化, 且二者均有多種不同分離模式。二者之間的差異在於:CE用遷移時間取代HPLC中的保留時間, CE的分析時間通常不超過30min, 比HPLC速度快;對CE而言, 從理論上推得其理論塔板高度和溶質的擴散係數成正比, 對擴散係數小的生物大分子而言, 其柱效就要比HPLC高得多;CE所需樣品為nl級, 最低可達270fl, 流動相用量也只需幾毫升, 而HPLC所需樣品為μl級, 流動相則需幾百毫升乃至更多;但CE僅能實現微量製備, 而HPLC可作常量製備。
CE和普通電泳相比, 由於其採用高電場, 因此分離速度要快得多;檢測器則除了未能和原子吸收及紅外光譜連接以外, 其它類型檢測器均已和CE實現了連接檢測;一般電泳定量精度差,而CE和HPLC相近;CE操作自動化程度比普通電泳要高得多。總之, CE的優點可概括為三高二少:高靈敏度, 常用紫外檢測器的檢測限可達10-13~10-15mol,雷射誘導熒光檢測器則達10-19~10-21mol;高解析度, 其每米理論塔板數為幾十萬;高者可達幾百萬乃至千萬, 而HPLC一般為幾千到幾萬;高速度, 最快可在60s內完成, 在250s內分離10種蛋白質, 1.7min分離19種陽離子, 3min內分離30種陰離子; 樣品少, 只需nl (10-9 L)級的進樣量;成本低, 只需少量(幾毫升)流動相和價格低廉的毛細管。由於以上優點以及分離生物大分子的能力, 使CE成為近年來發展最迅速的分離分析方法之一。當然CE還是一種正在發展中的技術, 有些理論研究和實際應用正在進行與開發。
「CE」統指以高壓電場為驅動力, 以毛細管為分離通道, 依據樣品中各組分間淌度和分配行為上的差異而實現分離的一類液相分離技術。(見圖16 毛細管電泳儀器示意圖)。其儀器結構包括一個高壓電源, 一根毛細管, 一個檢測器及兩個供毛細管兩端插入而又可和電源相連的緩衝液貯瓶。在電解質溶液中, 帶電粒子在電場作用下, 以不同的速度向其所帶電荷相反方向遷移的現象叫電泳。
CE所用的石英毛細管柱, 在pH>3情況下, 其內表面帶負電, 和溶液接觸時形成了一雙電層。在高電壓作用下, 雙電層中的水合陽離子引起流體整體地朝負極方向移動的現象叫電滲, 粒子在毛細管內電解質中的遷移速度等於電泳和電滲流(EOF)兩種速度的矢量和, 正離子的運動方向和電滲流一致, 故最先流出;中性粒子的電泳流速度為「零」,故其遷移速度相當於電滲流速度;負離子的運動方向和電滲流方向相反, 但因電滲流速度一般都大於電泳流速度, 故它將在中性粒子之後流出, 從而因各種粒子遷移速度不同而實現分離。
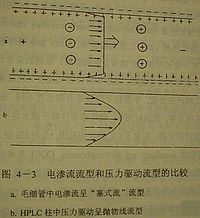
電滲是CE中推動流體前進的驅動力, 它使整個流體像一個塞子一樣以均勻速度向前運動, 使整個流型呈近似扁平型的「塞式流」。(見圖)它使溶質區帶在毛細管內原則上不會擴張。但在HPLC中,採用的壓力驅動方式使柱中流體呈拋物線型, 其中心處速度是平均速度的兩倍, 導致溶質區帶本身擴張, 引起柱效下降, 使其分離效率不如CE。
理論分析表明, 增加速度是減少譜帶展寬、提高效率的重要途徑, 增加電場強度可以提高速度。但高場強導致電流增加, 引起毛細管中電解質產生焦耳熱(自熱)。自熱將使流體在徑向產生拋物線型溫度分布, 即管軸中心溫度要比近壁處溫度高。因溶液粘度隨溫度升高呈指數下降, 溫度梯度使介質粘度在徑向產生梯度, 從而影響溶質遷移速度, 使管軸中心的溶質分子要比近管壁的分子遷移得更快, 造成譜帶展寬, 柱效下降。
一般來說溫度每提高1℃, 將使淌度增加2% (所謂淌度, 即指溶質在單位時間間隔內和單位電場上移動的距離)。此外, 溫度改變使溶液pH值、粘度等發生變化, 進一步導致電滲流、溶質分子的電荷分布(包括蛋白質的結構)、離子強度等的改變, 造成淌度改變、重複性變差、柱效下降等現象。降低緩衝液濃度可降低電流強度, 使溫差變化減小。高離子強度緩衝液可阻止蛋白質吸附於管壁, 並可產生柱上濃度聚焦效應, 防止峰擴張, 改善峰形。減小管徑在一定程度上緩解了由高電場引起的熱量積聚, 但細管徑使進樣量減少, 造成進樣、檢測等技術上的困難。因此, 加快散熱是減小自熱引起的溫差的重要途徑。液體的導熱係數要比空氣高100倍。現在有的採用液體冷卻方式的毛細管電泳儀可使用離子強度高達0.5mol/L的緩衝液進行分離, 或使用200 μm直徑的毛細管進行微量製備, 仍能達到良好的分離效果和重現性。
CE現有六種分離模式,分述如下:
1. 毛細管區帶電泳(capillary zone electrophoresis, CZE), 又稱毛細管自由電泳, 是CE中最基本、應用最普遍的一種模式。前述基本原理即是CZE的基本原理。
2. 膠束電動毛細管色譜 (micellar electrokinetic capillary chromatography, MECC), 是把一些離子型表面活性劑 (如十二烷基硫酸鈉, SDS) 加到緩衝液中, 當其濃度超過臨界濃度後就形成有一疏水核心、外部帶負電的膠束。雖然膠束帶負電, 但一般情況下電滲流的速度仍大於膠束的遷移速度, 故膠束將以較低速度向陰極移動。溶質在水相和膠束相(准固定相)之間產生分配, 中性粒子因其本身疏水性不同, 在二相中分配就有差異, 疏水性強的膠束結合牢, 流出時間長, 最終按中性粒子疏水性不同得以分離。MECC使CE能用於中性物質的分離, 拓寬了CE的應用範圍, 是對CE極大的貢獻。
3. 毛細管凝膠電泳 (capillary gel electrophoresis, CGE) 是將板上的凝膠移到毛細管中作支持物進行的電泳。凝膠具有多孔性,起類似分子篩的作用, 溶質按分子大小逐一分離。凝膠粘度大, 能減少溶質的擴散, 所得峰形尖銳, 能達到CE中最高的柱效。常用聚丙烯醯胺在毛細管內交聯製成凝膠柱, 可分離、測定蛋白質和DNA的分子量或鹼基數, 但其製備麻煩, 使用壽命短。如採用粘度低的線性聚合物如甲基纖維素代替聚丙烯醯胺, 可形成無凝膠但有篩分作用的無膠篩分(Non-Gel Sieving)介質。它能避免空泡形成, 比凝膠柱製備簡單,壽命長, 但分離能力比凝膠柱略差。CGE和無膠篩分正在發展成第二代DNA序列測定儀, 將在人類基因組織計劃中起重要作用。
4. 毛細管等電聚焦 (capillary isoelectric focusing, CIEF) 將普通等電聚焦電泳轉移到毛細管內進行。通過管壁塗層使電滲流減到最小, 以防蛋白質吸附及破壞穩定的聚焦區帶, 再將樣品與兩性電解質混合進樣, 兩端貯瓶分別為酸和鹼。加高壓(6~8kV)3~5min後, 毛細管內部建立pH梯度,蛋白質在毛細管中向各自等電點聚焦, 形成明顯的區帶。最後改變檢測器末端貯瓶內的pH值, 使聚焦的蛋白質依次通過檢測器而得以確認。
5. 毛細管等速電泳 (capillary isotachor-phoresis,,CITP) 是一種較早的模式, 採用先導電解質和後繼電解質, 使溶質按其電泳淌度不同得以分離, 常用於分離離子型物質, 目前應用不多。
6. 毛細管電色譜 (capillary electrochromatography, CEC) 是將HPLC中眾多的固定相微粒填充到毛細管中, 以樣品與固定相之間的相互作用為分離機制, 以電滲流為流動相驅動力的色譜過程, 雖柱效有所下降, 但增加了選擇性。此法有發展前景。
毛細管電泳 (CE) 除了比其它色譜分離分析方法具有效率更高、速度更快、樣品和試劑耗量更少、應用面同樣廣泛等優點外, 其儀器結構也比高效液相色譜 (HPLC) 簡單。CE只需高壓直流電源、進樣裝置、毛細管和檢測器。前三個部件均易實現, 困難之處在於檢測器。特別是光學類檢測器, 由於毛細管電泳溶質區帶的超小體積的特性導致光程太短, 而且圓柱形毛細管作為光學表面也不夠理想, 因此對檢測器靈敏度要求相當高。
當然在CE中也有利於檢測的因素, 如:在HPLC中, 因稀釋之故,溶質到達檢測器的濃度一般是其進樣端原始濃度的1%, 但在CE中, 經優化實驗條件後, 可使溶質區帶到達檢測器時的濃度和在進樣端開始分離前的濃度相同。而且CE中還可採用堆積等技術使樣品達到柱上濃縮效果, 使初始進樣體積濃縮為原體積的1/10~1%, 這對檢測十分有利。因此從檢測靈敏度的角度來說, HPLC具有良好的濃度靈敏度, 而CE提供了很好的質量靈敏度。總之, 檢測仍是CE中的關鍵問題,有關研究報導很多, 發展也很快。迄今為止, 除了原子吸收光譜、電感耦合電漿體發射光譜(ICP)及紅外光譜未用於CE外, 其它檢測手段如:紫外、熒光、電化學、質譜、雷射等類型檢測器均已用於CE。
與HPLC類似, CE中應用最廣泛的是紫外/可見檢測器。按檢測方式可分為固定波長或可變波長檢測器和二極體陣列或波長掃描檢測器兩類。前一類檢測器採用濾光片或光柵來選取所需檢測波長, 優點在於結構簡單, 靈敏度比後一類檢測器高;後一類檢測器能提供時間--波長--吸光度的三維圖譜, 優點在於在線紫外光譜可用來定性、鑒別未知物。有些商用儀器的二極體陣列檢測器還可做到在線峰純度檢查, 即在分離過程中便可得知每個峰含有幾種物質;缺點在於靈敏度比前一類略差。採用快速掃描的光柵獲取三維圖譜方式時, 其掃描速度受到機械動作速度的限制。用二極體陣列方式, 掃描速度受到計算機數據存貯容量大小的限制。由於CE的峰寬較窄, 理論上要求能對最窄的峰採集20個左右的數據, 因此要很好地選取掃描頻率, 才能得到理想的結果。
毛細管電泳基本原理
毛細管電泳(Capillary Electrophoresis,CE )是八十年代後期在全球範圍內迅速崛起的一種分離分析技術。具有快速、高效、高靈敏度、易定量、重現性好及自動化等優點,已廣泛地應用於小分子、小離子、多肽及蛋白質的分離分析研究。它又在核酸分離方面顯示出巨大的潛力。電流通過導體時產生焦耳熱。傳統平板凝膠電泳的最大局限性在於其無法克服兩端高電壓帶來的焦耳熱所產生的負面影響。焦耳熱可使篩分介質內部出現溫度、粘度及分離速度的不均一,影響遷移、降低效率、使區帶變寬。由於這種負面影響與電場強度成正比,所以極大地限制了高電壓的引入。也難以提高電泳速度。毛細管電泳使樣品在一根極細的柱子中進行分離。細柱可減小電流,使焦耳熱的產生減少;同時又增大了散熱面積,提高散熱效率,大大降低了管中心與管壁間的溫差,減少了柱子徑向上的各種梯度差,保證了高效分離。因此可以加大電場強度,達到100~200V/cm,全面提高分離質量。
毛細管電泳的基本裝置是一根充滿電泳緩衝液的毛細管和與毛細管兩端相連的兩個小瓶微量樣品從毛細管的一端通過「壓力」或「電遷移」進入毛細管。電泳時,與高壓電源連接的兩個電極分別浸人毛細管兩端小瓶的緩衝液中。樣品朝與自身所帶電荷極性相反的電極方向泳動。各組分因其分子大小、所帶電荷數、等電點等性質的不同而遷移速率不同,依次移動至毛細管輸出端附近的光檢測器,檢測、記錄吸光度,並在螢幕上以遷移時間為橫坐標,吸光度為縱坐標將各組分以吸收峰的形式動態直觀地記錄下來。
| 關於「毛細管電泳」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |