醫用化學/螯合物(內絡合物)
| 醫學電子書 >> 《醫用化學》 >> 配位化合物 >> 螯合物(內絡合物) |
| 醫用化學 |
|
|
一、螯合物的概念
螯合物又稱內絡合物,是螯合物形成體(中心離子)和某些合乎一定條件的螯合劑(配位體)配合而成具有環狀結構的配合物。「螯合」即成環的意思,猶如螃蟹的兩個螯把形成體(中心離子)鉗住似的,故叫螯合物。
形成螯合物的第一個條件是螯合劑必須有兩個或兩個以上都能給出電子對的配位原子(主要是N,O,S等原子)。第二個條件是每兩個能給出電子對的配位原子,必須隔著兩個或三個其他原子,因為只有這樣,才可以形成穩定的五原子環或六原子環。例如,在氨基乙酸根離子(H2N-CH2-COO-)中,給出電子的羥基氧和氨基氮之間,隔著兩個碳原子,因此它可以形成穩定的具有五原子環的化合物。
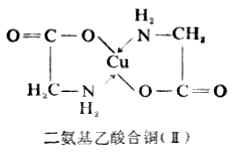
四原子環在螯合物中是不常見的,六原子以上的環也是比較少的。中心離子有一定的電荷數,同時也有一定的配位數。Cu(Ⅱ)帶有二個正電荷,它的配位數為4。氨基乙酸根離子(H2N-CH2-COO-)既有氨基氮,都能給出電子對;氨基氮能滿足中心離子的配位數,羥基氧則能使配位數和電荷數同時得到滿足,因此Cu 2+和兩個(H2N-CH2-COO-)螯合後,得到的是中性分子二氨基乙酸合銅(Ⅱ)(簡稱氨基乙酸酮)[Cu(H2N-CH2-COO)2]由於羥基氧帶有負電荷,故它與Cu 2+形成的配鍵通常用「-」表示。
螯合物的特殊穩定性是環形結構帶給它們的特徵之一。環愈多使螯合物愈穩定。通常所說的「螯合反應」就是指由於螯合而使化合物具有特殊的穩定性。
由於螯合物的特殊穩定性,已很少能反映金屬離子在未螯合前的性質。金屬離子在形成螯合物後,在顏色、氧化還原穩定性、溶解度及晶形等性質發生了巨大的變化。很多金屬螯合物具有特徵性的顏色,而且這些螯合物可以溶解於有機溶劑中。利用這些特點,可以進行沉澱、溶劑萃取分離、比色定量等分析分離工作。
二、螯合劑
常用的螯合劑是氨螯合劑,是一類似以氨基二乙酸[HN(CH2COOH)2]為基體的螯合劑,它以N,O為螯合原子,與金屬離子螯合時形成環狀的螯合物
![]()
常用的氨羧螯合劑有:
氨羧螯合劑Ⅰ(ATA)指的是氨三乙酸,它的結構是:
氨羧螯合劑Ⅱ(EDTA)指的是乙二胺四乙酸。它的結構是:
![]()
乙二胺四乙酸是四元酸,如果用Y表示它的酸根,則乙二胺四乙酸可以簡寫成H4Y。
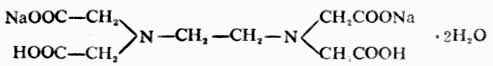
由於乙二胺四乙酸在水中的溶解度比較小,而其二鈉鹽在水中的溶解度卻比較大。因些在實際應用中人們常採用EDTA二鈉鹽。EDTA二鈉鹽含有2分子結晶水,它的結構是:
![]()
EDTA二鈉鹽有時也叫做EDTAⅢ。但習慣上仍把它叫做EDTA。用簡式Na2H2Y.2H2O表示它。
EDTA是四元酸,它在水中是分步離解的:
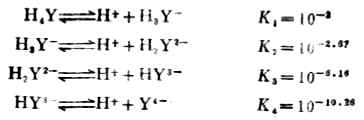
除鹼金屬離子外,EDTA幾乎能與所有的金屬離子形成穩定的金屬螯合物。並且,在一般情況下,不論金屬離子是幾價,1個金屬離子都能與1個EDTA酸根(Y4-)形成可溶性的穩定螯合物。例如:
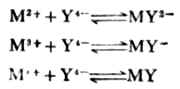
式中M表示金屬離子,右上角的數字和符號表示離子的離子價。
雖然,除鹼金屬離子外,各金屬離子大多數能與EDTA形成螯合物,但它們的穩定性差別很大。
EDTA是應用最廣的一種氨羧螯合劑,用EDTA標準液可以滴定幾十種金屬離子,這個方法就稱EDTA滴定法。目前所謂螯合滴定法主要是指EDTA滴定。
三、螯合物在醫學上的應用
螯合物在自然界存在得比較廣泛,並且對生命現象有著重要的作用。例如,血紅素就是一種含鐵的螯合物,它在人體內起著送氧的作用。
維生素B12是含鈷的螯合物,對惡性貧血有防治作用。胰島素是含鋅的螯合物,對調節體內的物質代謝(尤其是糖類代謝)有重要作用。有些螯合劑可用作重金屬(Pb2+,Pt2+,Cd2+,Hg2+)中毒的解毒劑。如二巰基丙醇或EDTA二鈉鹽等可治療金屬中毒。因為它們能和有毒金屬離子形成穩定的螯合物,水溶性螯合物可以從腎臟排出。
有些藥物本身就是螯合物。例如,有些用於治療疾病的某些金屬離子,因其毒性,刺激性、難吸收性等不適合臨床應用,將它們變成螯合物後就可以降低其毒性和刺激性,幫助吸收。
另外在生化檢驗、藥物分析、環境監測等方面也經常用到螯合物。
| 關於「醫用化學/螯合物(內絡合物)」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |