醫用化學/配合物的基本概念
| 醫學電子書 >> 《醫用化學》 >> 配位化合物 >> 配合物的基本概念 |
| 醫用化學 |
|
|
一、配合物的定義
如果在硫酸銅溶液中加入氨水,首先可得到淺藍色鹼式硫酸銅[Cu(OH)2]SO4沉澱,繼續加入氨水,則沉澱溶解而得到深藍色溶液。顯然由於加入過量的氨水,NH3分子與Cu2+離子間已發生了某種反應。
經研究確定,在上述溶液中生成了深藍色的複雜離子[Cu(NH3)4]2+。從溶液中還可結晶出深藍色[[Cu(NH3)4]SO4晶體。這說明CuSO4溶液與過量氨水發生了下列反應:
![]()
或離子方程式
![]()
已知NaCN,KCN有劇毒,但是亞鐵氰化鉀(K4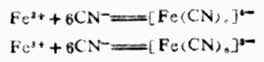
[Fe(CN)6])和鐵氰化鉀(K3[Fe(CN)6])雖然都含有氰根,卻沒有毒性,這是因為亞鐵離子或鐵離子與氰根離子結合成牢固的複雜離子,失去了原有的性質。
由一個陽離子(如Cu2+或Fe3+)和幾個中性分子(如NH3)或陰離子(如CN-)以配價鍵結合而成的,具有一定特性的複雜粒子,其帶有電荷的叫配離子或絡離子,其不帶電荷的叫配合分子或絡合分子。配合分子或含有配離子的化合物叫配合物。例如:[Cu(NH3)4]SO4,K4[Fe(CN)6],K3[Fe(CN)6],K2[HgI4],[Ag(NH3)2]NO3,[Pt(NH3)2CL4],[Co(NH3)5(H2O)]CL3等都是配合物。
二、配合物的組成
(一)中心離子
中心離子也稱配合物的形成體,它是配合物的核心部分,位於配離子(或分子)的中心,一般都是帶正電荷的,具有空的價電子軌道的陽離子。例如,上例中的Cu2+,Fe3+,Pt4+等。中心離子絕大數都是金屬離子。其中的過渡金屬離子是較強的配合物形成體。
(二)配位體
在配離子中同中心離子配合的離子(或分子)叫配位體。配位體是含有孤對電子的分子或陰離子,直接同中心離子結合的原子稱為配位原子。配位原子主要屬於周期表中Ⅴ、Ⅵ、Ⅶ三個主族元素。一個配位體可能含有一個以上的配位原子。
配合物一般可分為內界和外界兩個組成部分。中心離子和配位體組成配合物的內界,在配合物的化學式中一般用方括號表示內界,方括號以外的部分為外界。例如,在[Cu(NH3)4]SO4 中,四個NH3和一個Cu2+組成內界,一個SO2-4為外界。在K3[Fe(CN)6]中,六個CN-和一個F3+組成內界,三個K+為外界。
在[Pt(NH3)CL4]中,二個NH3,四個CL-和Pt4+為內界,它沒有外界。
配位體按所含配位原子的數目,可分為單齒配體和多齒配體。只有一個配位原子同中心離子配合的配位體,稱為單齒(或一價)配體,如F-,CL-,Br-,I-,CN-,NO-2,NO-3,NH3,H2O等。有兩個以上的配位原子同時跟一個中心離子配合的配位體,統稱為多齒配體,如乙二胺H2N-CH2-CH2-NH2,有兩個氨基氮是配位原子。又如,乙二胺四乙酸根(-OOC-CH2)2N-CH2-CH2-N(CH2-COO-)2中,除有兩個氨基氮是配位原子外,還有四個羥基氧也是配位原子。
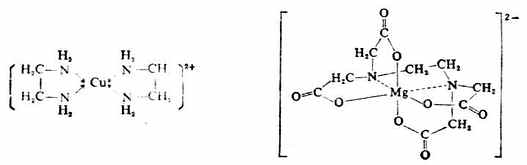
現將常見的配位體列入表5-1。
表5-1 常見的配位體
| 配位原子 | 配位體舉例 |
| 鹵素 | F-,CL-,Br-,I- |
| O | H2O,RCOO-,C2O2-4(草酸根離子) |
| N | NH3,NO(亞硝基),NH2-CH2-CH2-NH2(乙二胺) |
| C | CN-(氰離子) |
| S | SCN-(硫氰根離子) |
(三)配位數
在內界里,與中心離子的結合的配位原子的數目,叫做該中心離子的配位數。一般中心離子的配位數為2,4,6,8。最常見的是4和6(表5-2)
表5-2 常見離子的配位數
| 配位數 | 離子 |
| 2 | Ag+,Cu2+,Au+ |
| 4 | Zn2+,Cu2+,Hg2+,Ni2+,Co2+,Pt2+,Pd2+,Si4+,Ba2+ |
| 6 | Fe2+,Fe3+,Co2+,Co3+,Cr3+,Pt4+,Pd4+,Al3+,Si4+,Ca2+,Ir3+ |
| 8 | Mo4+,W4+,Ca2+,Ba2+,Pb2+ |
| 配位數 | 離子 |
在計算中心離子的配位數時,一般是先在配合物中確定中心離子和配位體,接著找出配位原子的數目。如果配位體是單齒的,配位體的數目就是該中心離子的配位數。例如,[Pt(NH3)4]Cl2和[Pt(NH3)2Cl2]中的中心離子都是Pt2+,而配位體前者是NH3,後者是NH3和Cl--,這些配位體都是單齒的,因此它們的配位數都是4。
如果配位體是多齒的,那麼配位體的數目顯然不等於中心離子的配位數(見螯合物一節)。
(四)配離子(或絡離子)的電荷
配離子的電荷等於中心離子電荷與配位體電荷的代數和。
[Cu(NH3)4]2++2+4×0=+2
[Fe(CN)6]3- +3+6×(-1)=-3
[Fe(CN)6]4- +2+6×(-1)=-4
[HgI4]2- +2+4×(-1)=-2
三、配合物的命名
配合物的命名方法從一般無機物的命名原則:陰離子名稱在前,陽離子名稱在後;當配離子是陽離子時,外界陰離子為酸根;當配離子是陰離子時,則該配離子為酸根。命名時,酸根為簡單離子時稱「某化某」,酸根為複雜離子時稱「某酸某」。在命名配離子時,要在形成體與配位體的名稱間加個「合」字,並按下列順序列出其組成部分的名稱。配位體數-配位體名稱-「合」字-形成體名稱-形成體價態(用羅馬數字表示)。當配位體個數為一時,有時可將「一」字省去。若形成體僅有一種價態時也可不加註羅馬數字。如果內界中含有不止一種配位體,則命名時,陰離子配位體在先,中性分子配位體在後。對於幾種不同陰離子組成的配位體,命名順序為:簡單陰離子-複雜陰離子-有機酸根離子。對於幾種中性分子組成的配位體,命名順序為:簡單陰離子-複雜陰離子-有機酸根離子。對於幾種中性分子組成的配位體,命名順序為:水-氨-有機分子。
配位體的個數用一、二、三等表示。
中心離子的價態用Ⅰ、Ⅱ、Ⅲ等表示。
例如:
[Cu(NH3)4]2+四氨合銅(Ⅱ)離子
[Fe(CN)6]3- 六氰合鐵(Ⅲ)離子
配離子是陽離子的配合物:
[Co(NH3)4CL2]CL氯化二氯四氨合鈷(Ⅲ)
[Cu(NH3)4]SO4硫酸四氨合銅(Ⅱ)
配離子是陰離子的配合物:
K2[PtCL6]六氯合鉑(Ⅳ)酸鉀
Na4[Fe(CN)6] 六氰合鐵(Ⅱ)酸鈉
在不致引起誤解的情況下,「合」字和價數有時可以省略。如二氯二氨合鐵(Ⅱ)可稱為二氯二氨鉑,稱為氯化二氨銀。
有些常見的配合物和配離子可用簡稱。
K4[Fe(CN)6] 亞鐵氰化鉀
K3[Fe(CN)6] 鐵氰化鉀
K2[PtCL6] 氯鉑酸鉀
K2[HgI4]碘化汞鉀
[Ag(銀NH3)2]+ 氨配離子
[PtCL6]2- 氯鉑酸根
| 關於「醫用化學/配合物的基本概念」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |