乙酸乙酯
| A+醫學百科 >> 乙酸乙酯 |
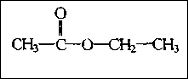
乙酸乙酯是乙酸中的羥基被乙氧基取代而生成的化合物,結構簡式為CH3COOCH2CH3。
乙酸乙酯 ethyl acetate
乙酸乙酯又稱醋酸乙酯。純淨的乙酸乙酯是無色透明有芳香氣味的液體,是一種用途廣泛的精細化工產品,具有優異的溶解性、快乾性,用途廣泛,是一種非常重要的有機化工原料和極好的工業溶劑,被廣泛用於醋酸纖維、乙基纖維、氯化橡膠、乙烯樹脂、乙酸纖維樹酯、合成橡膠、塗料及油漆等的生產過程中。其主要用途有:作為工業溶劑,用於塗料、粘合劑、乙基纖維素、人造革、油氈著色劑、人造纖維等產品中;作為粘合劑,用於印刷油墨、人造珍珠的生產;作為提取劑,用於醫藥、有機酸等產品的生產;作為香料原料,用於菠蘿、香蕉、草莓等水果香精和威士忌、奶油等香料的主要原料。我們所說的陳酒很好喝,就是因為酒中含有乙酸乙酯。乙酸乙酯具有果香味。因為酒中含有少量乙酸,和乙醇進行反應生成乙酸乙酯。因為這是個可逆反應,所以要具有長時間,才會積累導致陳酒香氣的乙酸乙酯。
名稱
名稱1: 乙酸乙酯 ethyl acetate
名稱2: 醋酸乙酯 acetic ester
CAS No.: 141-78-6
分子式 C4H8O2
結構式CH3COOC2H5
相對分子質量 88.11
存在:除人工合成外,還存在於許多酒以及菠蘿、香蕉等果品中。
目錄 |
外觀與性狀
外觀:無色澄清液體。
香氣:有強烈的醚似的氣味,清靈、微帶果香的酒香,易擴散,不持久。
熔點(℃): -83.6
折光率(20℃):1.3708--1.3730
沸點(℃): 77.06
相對密度(水=1): 0.894--0.898
相對蒸氣密度(空氣=1): 3.04
飽和蒸氣壓(kPa): 13.33(27℃)
燃燒熱(kJ/mol): 2244.2
臨界溫度(℃): 250.1
臨界壓力(MPa): 3.83
辛醇/水分配係數的對數值: 0.73
閃點(℃)(開杯): 7.2
引燃溫度(℃): 426
爆炸上限%(V/V): 11.5
爆炸下限%(V/V): 2.0
室溫下的分子偶極距:6.555*10^-30
溶解性: 微溶於水,溶於醇、酮、醚、氯仿等多數有機溶劑。
主要用途
用途很廣。主要用作溶劑,及用於染料和一些醫藥中間體的合成。是食用香精中用量較大的合成香料之一,大量用於調配香蕉、梨、桃、菠蘿、葡萄等香型食用香精.
注意事項
1.健康危害: 對眼、鼻、咽喉有刺激作用。高濃度吸入可進行麻醉作用,急性肺水腫,肝、腎損害。持續大量吸入,可致呼吸麻痹。誤服者可產生噁心、嘔吐、腹痛、腹瀉等。有致敏作用,因血管神經障礙而致牙齦出血;可致濕疹樣皮炎。慢性影響:長期接觸本品有時可致角膜混濁、繼發性貧血、白細胞增多等。
2.燃爆危險: 本品易燃,具刺激性,具致敏性。
3.危險特性: 易燃,其蒸氣與空氣可形成爆炸性混合物,遇明火、高熱能引起燃燒爆炸。與氧化劑接觸猛烈反應。其蒸氣比空氣重,能在較低處擴散到相當遠的地方,遇火源會著火回燃。
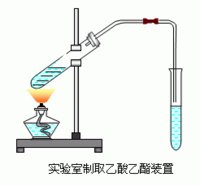
實驗室製取乙酸乙酯
乙酸乙酯的製取:先加乙醇,再加濃硫酸(加入碎瓷片以防暴沸),最後加乙酸, 然後加熱(可以控制實驗)
乙酸的酯化反應制乙酸乙酯的方程式:
CH3COOH+CH3CH2OH===CH3COOC2H5+H2O
(可逆反應、加熱、濃硫酸催化劑、吸水劑、脫水劑)
1:酯化反應是一個可逆反應。為了提高酯的產量,必須盡量使反應向有利於生成酯的方向進行。一般是使反應物酸和醇中的一種過量。在工業生產中,究竟使哪種過量為好,一般視原料是否易得、價格是否便宜以及是否容易回收等具體情況而定。在實驗室里一般採用乙醇過量的辦法。乙醇的質量分數要高,如能用無水乙醇代替質量分數為95%的乙醇效果會更好。催化作用使用的濃硫酸量很少,一般只要使硫酸的質量達到乙醇質量的3%就可完成催化作用,但為了能除去反應中生成的水,應使濃硫酸的用量再稍多一些。
2:製備乙酸乙酯時反應溫度不宜過高,要保持在60 ℃~70 ℃左右,溫度過高時會產生乙醚和亞硫酸等雜質。液體加熱至沸騰後,應改用小火加熱。事先可在試管中加入幾片碎瓷片,以防止液體暴沸。
3導氣管不要伸到Na2CO3溶液中去,防止由於加熱不均勻,造成Na2CO3溶液倒吸入加熱反應物的試管中。
3.1:濃硫酸既作催化劑,又做吸水劑和脫水劑。
3.2:Na2CO3溶液的作用是:
(1)飽和碳酸鈉溶液的作用是冷凝酯蒸氣,減小酯在水中的溶解度(利於分層),除出混合在乙酸乙酯中的乙酸,溶解混合在乙酸乙酯中的乙醇。
(2)Na2CO3能跟揮發出的乙酸反應,生成沒有氣味的乙酸鈉,便於聞到乙酸乙酯的香味。
3.3:為有利於乙酸乙酯的生成,可採取以下措施:
(1)製備乙酸乙酯時,反應溫度不宜過高,保持在60 ℃~70 ℃。不能使液體沸騰。
(2)最好使用冰醋酸和無水乙醇。同時採用乙醇過量的辦法。
(3)起催化作用的濃硫酸的用量很小,但為了除去反應中生成的水,濃硫酸的用量要稍多於乙醇的用量。
(4)使用無機鹽Na2CO3溶液吸收揮發出的乙酸。
3.4:用Na2CO3不能用鹼(NaOH)的原因。
雖然也能吸收乙酸和乙醇,但是鹼會催化乙酸乙酯徹底水解,導致實驗失敗。
參見
烷基乙酸酯
.乙酸甲酯(methyl acetate)
.乙酸丙酯(n-Propyl acetate )
.乙酸異丙酯(isopropyl acetate)
.乙酸丁酯(butyl acetate)
.乙酸異丁酯(isobutyl acetate)
.乙酸戊酯(amyl acetate)
.乙酸異戊酯(isoamyl acetate)
.乙酸己酯(hexyl acetate)
.乙酸庚酯(n-heptyl acetate)
.乙酸辛酯(octyl acetate)
.乙酸壬酯(nonyl acetate)
.乙酸癸酯(decyl acetate)
| 關於「乙酸乙酯」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |