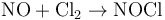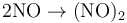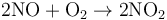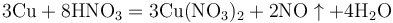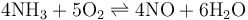一氧化氮
| A+醫學百科 >> 一氧化氮 |
| 一氧化氮 | |
|---|---|
 |
|
 |
|
| IUPAC名 Nitric oxide |
|
| 識別 | |
| CAS號 | 10102-43-9 |
| 性質 | |
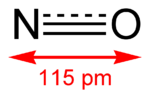
| 化學式 | NO |
| 摩爾質量 | 30.0061 g·mol⁻¹ |
| 外觀 | 無色氣體 |
| 密度 | (液) 1.3 × 103 kg m−3 (氣) 1.34kg m−3 |
| 熔點 | −163.6°C (109.6 K) |
| 沸點 | −151.7°C (121.4 K) |
| 危險性 | |
| 歐盟危險性符號 |
|
| 警示術語 | R:R9-R23-R24-R25-R34-R44 |
| 安全術語 | S:S23-S36-S37-S39 |
| NFPA 704 | |
| 若非註明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |
一氧化氮是氮的化合物,化學式NO,分子量30,氮的化合價為+2。由於一氧化氮帶有自由基,這使它個化學性質非常活潑。具有順磁性。當它與氧反應後,可形成具有腐蝕性的氣體——二氧化氮(NO2)。一氧化氮在標準狀況下為無色氣體,液態、固態呈藍色。
目錄 |
作用
一氧化氮起著信使分子的作用。當內皮要向肌肉發出放鬆指令以促進血液流通時,它就會產生一些一氧化氮分子,這些分子很小,能很容易地穿過細胞膜。血管周圍的平滑肌細胞接收信號後舒張,使血管擴張。
一氧化氮也能在神經系統的細胞中發揮作用。它對周圍神經末梢或許有所作用。
免疫系統產生的一氧化氮分子,不僅能抗擊侵入人體的微生物,而且還能夠在一定程度上阻止癌細胞的繁殖,阻止腫瘤細胞擴散。
一氧化氮對血管有三大作用:1、血管擴張 2、防止低密度脂蛋白(LDL)氧化,降低單核細胞黏附血管壁 3、降低血小板的黏稠度
結構
一氧化氮為雙原子分子,分子構型為直線型。一氧化氮中,氮與氧之間形成一個σ鍵、一個2電子π鍵與一個3電子π鍵。氮氧之間鍵級為2.5,氮與氧各有一對孤對電子。有11個價電子,是奇電子分子,具有順磁性。分子軌道式:
- (σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)1
反鍵軌道上(π2p*)1易失去生成亞硝醯陽離子NO+:
可以二聚生成(NO)2,在固態中少量存在:
性質
還原性
一氧化氮易被氧化生成二氧化氮,處於空氣中的一氧化氮很快會被空氣中的氧氣氧化生成紅棕色二氧化氮。工業上可用此法生產硝酸。
製取
實驗室用銅與稀硝酸共熱製取一氧化氮:
工業上用氨氣在鉑(石棉載體)或鉑銠合金網催化下氧化生成一氧化氮,這是工業上制硝酸的重要反應:
配位性
由於孤對電子的存在,一氧化氮易與金屬離子形成配合物。可與血紅蛋白結合,使人窒息中毒。
如一氧化氮可與Fe2+生成棕色亞硝醯亞鐵離子,稱為棕色環反應,為檢驗亞鐵離子的反應之一:
- Fe2+ + NO + H2O → [Fe(H2O)5NO]2+
其中Fe為Fe(II)
NO可與過渡金屬以端基、邊橋基、面橋基形式配位。
生物活性
- 在心血管中,一氧化氮對維持血管張力的恆定與調節血壓穩定起著重要作用。硝酸甘油治療心絞痛正是由於其在體內轉化成NO,擴張血管。
- 在免疫系統中,NO起殺傷細菌、病毒、腫瘤細胞的作用。
- 在神經系統中,一氧化氮促進學習、記憶過程,並可調節腦血流
參考來源
| 關於「一氧化氮」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |