蘭尼鎳
| A+醫學百科 >> 蘭尼鎳 |

蘭尼鎳(Raney nickel),是一種由帶有多孔結構的鎳鋁合金的細小晶粒組成的固態異相催化劑,它最早由美國工程師莫里.蘭尼在植物油的氫化過程中,作為催化劑而使用。[1]其製備過程是把鎳鋁合金用濃氫氧化鈉溶液處理,在這一過程中,大部分的鋁會和氫氧化鈉反應而溶解掉,留下了很多大小不一的微孔。這樣蘭尼鎳表面上是細小的灰色粉末,但從微觀角度上,粉末中的每個小顆粒都是一個體多孔結構,這種多孔結構使得它的表面積大大增加,極大的表面積帶來的是很高的催化活性,這就使得蘭尼鎳作為一種異相催化劑被廣泛用於有機合成和工業生產的氫化反應中。由於「蘭尼」是格雷斯化學品公司的註冊商標,所以嚴格地說,僅有這個公司的戴維森化學部門生產的產品才能稱作「蘭尼鎳」。而「金屬骨架催化劑」[2]或者「海綿-金屬催化劑」被用於稱呼具有微孔結構,而物理和化學性質類似於蘭尼鎳的催化劑。
歷史
1897年法國化學家保羅.薩巴捷發現了痕量的鎳可以催化有機物氫化過程。[3]隨後鎳被應用於很多有機物的氫化。1920年代起美國工程師莫里.蘭尼開始致力於尋找更好的氫化催化劑。1924年他採用鎳/矽比例為1:1的混合物,經過氫氧化鈉處理後,矽和氫氧化鈉反應掉,形成多孔結構。蘭尼發現這種催化劑對棉籽油氫化的催化活性是普通鎳的五倍。[4]隨後蘭尼使用鎳/鋁為1:1的合金來製造催化劑,發現得到的催化劑活性更高,並於1926年申請專利。[5]直到今天,1:1的比例仍然是生產蘭尼鎳所需的合金的首選比例。
製備
合金製備
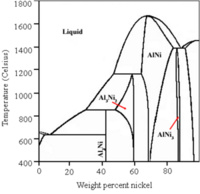
商業上,生產蘭尼鎳所需的鎳鋁合金是通過在熔爐中將具有催化活性的金屬(鎳,鐵或者銅)和鋁熔合,得到的熔體進行淬火冷卻,然後粉碎成為均勻的細顆粒。[6]在合金組分的設計上,要考慮兩個因素。一是合金中鎳鋁的組成比例,隨著鎳鋁比例的變化,在淬火過程中會產生不同的鎳/鋁相,他們有著不同的浸出性能,這可能會導致最終產品有著截然不同的多孔結構。通常採用相等質量的鎳和鋁進行熔合。二是加入第三種金屬的比例。在淬火過程中,有時會加入少量的第三種金屬,如鋅,鉻。它們的加入改變了合金的組成和相圖,導致了不同的浸出性能,從而帶來了更高的催化活性,所以被稱為「促進劑」[7] 。
鎳-鋁相圖,標出了和浸出反應密切的NiAl3、Ni2Al3和NiAl相
活化
蘭尼鎳的高催化活性來自於鎳本身的催化性質和其多孔的結構,而多孔結構即源自於用濃氫氧化鈉溶液除去鎳鋁合金中的鋁,這一過程被稱為浸出,簡化之後的浸出反應如下:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
由於浸出反應帶來了催化劑的活性,同時產生的氫氣儲存進了催化劑中,故也稱之為活化。成品的表面積通常通過氣體(如氫氣)的吸附實驗來測量。實驗發現幾乎所有的接觸面積都存在著鎳。商業化的蘭尼鎳的平均鎳接觸面積是100 m² /g。[8] 。主要有三個因素影響著浸出反應的結果,他們是合金的組成,所用氫氧化鈉的濃度和浸出反應的溫度。
前面提到過,合金中含有多種鎳鋁相,在浸出過程中,NiAl3和Ni2Al3相之中所含的鋁首先被反應掉,而NiAl相中含有的鋁反應較慢,可以通過調整浸出時間保留,這就是為什麼被稱為「選擇性浸出」。典型的活化蘭尼鎳中鎳佔85%的質量,這意味這有2/3的原子是鎳。剩餘的NiAl相中的鋁可以幫助保持這種多孔的結構,為催化劑提供結構的穩定性和熱的穩定性。
浸出反應所用的氫氧化鈉的濃度要比較高,一般需達5摩爾/升,這樣才能迅速將鋁轉化為溶於水的鋁酸鈉(Na[Al(OH)4]),而避免產生氫氧化鋁沉澱。一旦產生氫氧化鋁的沉澱,沉澱會堵塞已形成的孔洞,阻止其餘的氫氧化鈉溶液進入合金的路徑,使得剩餘的鋁較難反應掉。這樣會導致產品的多孔結構的表面積變小,催化活性降低。
在浸出過程中逐步形成的多孔結構具有強烈的縮小其表面積的傾向,會發生結構重排,孔壁彼此結合,使得多孔結構被破壞。而溫度的升高會使得原子運動加快,加大了結構重排的趨勢,所以雷尼鎳的表面積和催化活性都隨浸出反應溫度的升高而下降,而如果浸出溫度很低,又會使得浸出反應速度過慢,故常用的浸出反應溫度介於70至100攝氏度。[9]
應用
對氫氣的強吸附性,高催化活性和熱穩定性使得蘭尼鎳被廣泛用於很多工業過程和有機合成反應中。除此之外,蘭尼鎳基本不溶於除無機酸之外的實驗室溶劑,同時又具有較高的密度(和鎳類似,6-7g/cm³),這都有利於反應之後從混合液中分離催化劑。
氫化反應
蘭尼鎳主要用於不飽和化合物,如烯烴[10],炔烴,腈[11],二烯烴,芳香烴,含羰基的物質,乃至具有不飽和鍵的高分子[12]的氫化反應。使用蘭尼鎳進行氫化有時甚至不需要特意加入氫化,僅憑活化後的蘭尼鎳中吸附的大量氫氣即可完成反應。反應後得到的是順位氫化產物。[13]另外,蘭尼鎳也可以用於雜原子-雜原子鍵的還原[14]。一個典型的使用蘭尼鎳加氫的反應如下:
在這個反應中苯被加氫還原為環己烷。由於芳香族化合物的特殊穩定性,直接氫化還原很困難。但是使用蘭尼鎳可以加快反應速度。其他非均相催化劑,如鉑族元素組成的催化劑,可以達到類似的效果,但生產費用昂貴。還原之後得到的環己烷可以被氧化成己二酸,己二酸作為原料用於工業生產聚醯胺如尼龍等。
脫硫
除了作為催化劑加氫,蘭尼鎳還將充當試劑參與有機含硫化合物如硫縮醛的脫硫生成烴類的反應。
生成的硫化亞鎳將沉澱下來,通過蒸餾,可以與易揮發的乙烷很容易分離。蘭尼鎳還用於噻吩脫硫同時氫化生成飽和化合物。[15]但這一類反應的機理至今還未有明確解釋。[16]
安全
蘭尼鎳包裝,因為其是可燃有害物質,包裝盒內填充蛭石
在蘭尼鎳製備過程中,使用的原料鎳是一種國際癌症研究機構(Internation Agency for Research on Cancer)認為的致癌物(2B組,歐盟第3類)和致畸物,而吸入微細的氧化鋁粒子會導致鋁礬土塵肺症,因此製備雷尼鎳一定要小心。在活化過程中,由於其表面積在逐漸增大且不斷吸附浸出反應所產生的氫氣,使得活化後形成的蘭尼鎳具備中等易燃性,故雷尼鎳參加的反應應在惰性氣體的環境中進行處理。
活化之後,得到的催化劑要在室溫下用蒸餾水清洗,為的是除去任何殘餘的鋁酸鈉。去氧水是儲存蘭尼鎳的首選,因為它可以防止蘭尼鎳的氧化,降低燃燒的危險。所以,通常供應的蘭尼鎳是混於水中的50%的泥漿狀物體,不要把其暴露於空氣中。泥漿狀物質裝入試劑瓶中後放入包裝箱,包裝箱中要填充化學性質穩定的蛭石再加以運輸。
參加反應之後的蘭尼鎳仍然可能含有大量的氫氣,不能隨意丟棄。應在通風處銷毀。蘭尼鎳燃燒時會產生有害氣體,因此,建議在銷毀蘭尼鎳和撲救蘭尼鎳造成的火災時使用防毒面具。此外,直接接觸蘭尼鎳可能會導致呼吸道發炎,也可以引起眼睛和皮膚刺激性的損害。吸入會導致鼻腔和肺部的纖維化。攝入則會導致驚厥和腸道疾病。長期接觸可能導致肺炎和其他標誌致敏鎳樣皮疹,即鎳癢。[17]
參考文獻
^Raney, Murray (1927). "Method of producing Finely Divided Nickel". US Patent 1628190, issued 1927-05-10.
^《中國大百科全書.化學卷》金屬催化劑條目
^ [1] 薩巴捷在諾貝爾獎頒獎典禮上的演講。
^ Raney, Murray (1925). "Method of Preparing Catalytic Material". US Patent 1563587, issued 1925-12-01
^ Raney, Murray (1927). "Method of producing Finely Divided Nickel". US Patent 1628190, issued 1927-05-10
^ Ertl, Gerhard; Knözinger, Helmut (Eds.) (1997). Preparation of Solid Catalysts, Weinheim: Wiley. ISBN 3-527-29826-6。
^ Ertl, Gerhard; Knözinger, Helmut (Eds.) (1997). Preparation of Solid Catalysts, Weinheim: Wiley. ISBN 3-527-29826-6。
^ Ertl, Gerhard; Knözinger, Helmut (Eds.) (1997). Preparation of Solid Catalysts, Weinheim: Wiley. ISBN 3-527-29826-6。
^ A.J. Smith and D.L. Trimm (2005). Annual Reviews in Materials Research, 35, 127–142.。
^ Smith March, March』s Advanced Organic Chemistry, 5th Edition,2003,ISBN0-471-58589-0
^ Egli.R.A Helv Chim Acta,1970,53,47
^ 《中國大百科全書.化學卷》高分子氫化條目
^ Smith March, March』s Advanced Organic Chemistry, 5th Edition,2003,ISBN0-471-58589-0
^ Alexakis, A.; Lensen, N. Mangeney, P. Synlett 1992, 3, 625.
^ Högsberg, H. E.; Hedenström, E.; Fägerhag, J.; Servi, S. J. Org. Chem. 1992, 57, 2052. (DOI:10.1021/jo00033a028)
^ Smith March, March』s Advanced Organic Chemistry, 5th Edition,2003,ISBN0-471-58589-0
^ Electronic Space Products International (1994). Nickel aluminide MSDS. Last retrieved January 25, 2006.
| 關於「蘭尼鎳」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |