吡咯
| A+醫學百科 >> 吡咯 |
| 吡咯 | |||
|---|---|---|---|
|
|
|||
|
|
|||
 |
|||
| IUPAC名 Pyrrole Pyrrol |
|||
| 識別 | |||
| CAS號 | 109-97-7 | ||
| PubChem | 8027 | ||
| ChemSpider | 7736 | ||
| SMILES |
|
||
| InChI |
|
||
| Beilstein | 1159 | ||
| Gmelin | 1705 | ||
| UN編號 | 1992, 1993 | ||
| EINECS | 203-724-7 | ||
| ChEBI | 19203 | ||
| RTECS | UX9275000 | ||
| 性質 | |||
| 化學式 | C4H5N | ||
| 摩爾質量 | 67.09 g·mol⁻¹ | ||
| 密度 | 0.967 g/cm3 | ||
| 熔點 | −23 °C | ||
| 沸點 | 129–131 °C | ||
| 熱力學 | |||
| ΔfHm |
108.2 kJ mol–1 (氣態) | ||
| ΔcHm |
2242 kJ mol–1 | ||
| 熱容 | 1.903 J k–1 mol–1 | ||
| 危險性 | |||
| NFPA 704 | |||
| 閃點 | 33.33 °C | ||
| 自燃溫度 | 550 °C | ||
| 爆炸極限 | 3.1–14.8% | ||
| 相關物質 | |||
| 相關化學品 | 吲哚,呋喃,噻吩,吡啶 | ||
| 若非註明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |||
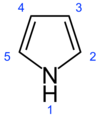
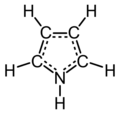
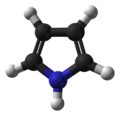
吡咯(Pyrrole,1-氮雜-2,4-環戊二烯),雜環化合物之一。分子式C4H5N,分子量:67.09,CAS號109-97-7。熔點-23℃,沸點129-131℃,密度0.967g/cm3。
多個吡咯環可以形成更大的環系,如血紅蛋白中的卟啉環,葉綠素中的卟吩環和維生素B12中的咕啉環。[1]
目錄 |
性質與反應
酸鹼性
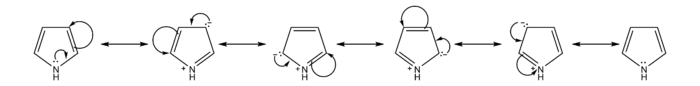
吡咯鹼性較其它胺類弱,其共軛酸的pKaH約為–1到–2。這是因為氮原子上的一對電子與兩個雙鍵上的電子形成離域體系(Π56)。正因為如此,吡咯有芳香性,形成共軛酸後芳香體系被破壞,故吡咯氮不易結合質子。
吡咯有微弱酸性,其pKa為16.5。用正丁基鋰和氫化鈉之類的強鹼處理吡咯得其負離子,與親電試劑如碘甲烷反應得N-甲基吡咯。
芳香性
與苯和其它五元雜環化合物比較,親電取代反應活性吡咯>呋喃>噻吩>苯。吡咯親電取代反應反應活性非常高,例如吡咯在氫氧化鈉作用下與碘反應生成四碘吡咯。[2]這是由於吡咯π電子云密度高於苯,且碳正離子中間體非常穩定。吡咯硝化不宜直接使用硝酸,因易被氧化,常使用溫和的非質子試劑硝酸乙醯酯;磺化也避免使用硫酸,常用吡啶與三氧化硫加合物作磺化試劑。[3]
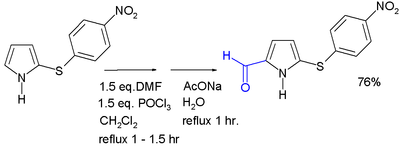
吡咯親電取代反應α位活性更高,可通過曼尼希反應或Vilsmeier-Haack反應從吡咯製備α位上有取代基的衍生物。[4]
吡咯與醛縮合得卟啉環,如苯甲醛與吡咯反應,冷凝得四苯基卟啉。對於取代吡咯,如已有基團為鄰對位定位基,第二個基團進入相鄰α位;如為間位定位基,則進入間位α位。[3]
聚合
吡咯在濃酸中樹脂化,在冷的稀酸或三氯化鐵的甲醇溶液中聚合,得到導電化合物聚吡咯。[2]
- n C4H4NH + 2 FeCl3 → (C4H2NH)n + 2 FeCl2 + 2 HCl
氧化
與其它胺一樣,吡咯在空氣中和光照下氧化變黑,生成聚吡咯和多種胺氧化物。因此吡咯使用前需要蒸餾。[5]
D-A反應
吡咯在一定條件下例如路易斯酸催化,或加熱,高壓而作為雙烯體參與D-A反應。
合成
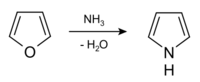
工業上吡咯由呋喃在固體酸催化劑作用下與氨反應得到。[6]
以氧化鋁為催化劑,在氨的作用下可從呋喃和噻唑合成吡咯。這個反應名為Yurev合成,可實現吡咯、呋喃、噻吩環系的互變。[3]
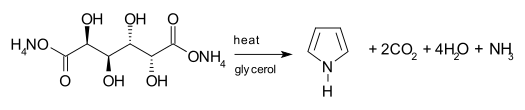
另一種方法是由半乳糖二酸的銨鹽脫水製得。通常用甘油作溶劑,加熱半乳糖二酸銨,蒸出生成的吡咯。[7]
取代吡咯的合成
取代吡咯有多種合成方法,較經典的有Knorr吡咯合成,Hantzsch吡咯合成與Paal-Knorr合成。
Piloty–Robinson吡咯合成使用肼和2倍當量的醛做原料,[8][9]合成3,4位上具有特定取代基的吡咯。 反應生成二亞胺中間體(R–C=N−N=C–R),然後在鹽酸作用下重排,失去一分子氨關環得取代吡咯。
在上述反應的第二步發生了[3,3]σ遷移。
相關條目
參考資料
- ↑ Jonas Jusélius and Dage Sundholm. The aromatic pathways of porphins, chlorins and bacteriochlorins (Open access). Phys. Chem. Chem. Phys.. 2000, 2 (10): 2145–2151. doi:10.1039/b000260g.
- ↑ 2.0 2.1 王積濤,張保申,王永梅,胡青眉編著。2003年。《有機化學(第二版)》。天津南開大學出版社 ISBN 9787310006205
- ↑ 3.0 3.1 3.2 邢其毅等。《基礎有機化學》第三版下冊。北京:高等教育出版社,2005年。ISBN 978-7-04-017755-8
- ↑ Jose R. Garabatos-Perera, Benjamin H. Rotstein, and Alison Thompson. Comparison of Benzene, Nitrobenzene, and Dinitrobenzene 2-Arylsulfenylpyrroles. J. Org. Chem.. 2007, 72 (19): 7382–7385. doi:10.1021/jo070493r. PMID 17705533.
- ↑ Armarego, Wilfred, L.F.; Chai, Christina, L.L.. Purification of Laboratory Chemicals. 5th. Elsevier. 2003: pp. 346.
- ↑ Albrecht Ludwig Harreus "Pyrrole" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_453
- ↑ Practical Organic Chemistry, Vogel, 1956, Page 837, Link (12 MB)
- ↑ Piloty, O.. Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen. Chem. Ber.. 1910, 43: 489. doi:10.1002/cber.19100430182.
- ↑ Robinson, Gertrude Maud; Robinson, Robert. LIV.-A new synthesis of tetraphenylpyrrole. J. Chem. Soc.. 1918, 113: 639. doi:10.1039/CT9181300639.
- ↑ 10.0 10.1 Benjamin C. Milgram, Katrine Eskildsen, Steven M. Richter, W. Robert Scheidt, and Karl A. Scheidt. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC1939979/ Microwave-Assisted Piloty–Robinson Synthesis of 3,4-Disubstituted Pyrroles] (Note). J. Org. Chem.. 2007, 72 (10): 3941–3944. doi:10.1021/jo070389. PMID 17432915. PMC 1939979.
參考來源
| 關於「吡咯」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |



![Piloty–Robinson合成[10]](http://p.ayxbk.com/images/thumb/b/bd/Piloty-Robinson_reaction.png/400px-Piloty-Robinson_reaction.png)