醫用化學/氧化還原滴定法
| 醫學電子書 >> 《醫用化學》 >> 滴定分析 >> 氧化還原滴定法 |
| 醫用化學 |
|
|
一、概述
氧化還原滴定法是以氧化還原反應為基礎的滴定分析方法。氧化還原反應較為複雜,一般反應速度較慢,副反應較多,所以並不是所有的氧化還原反應都能用於滴定反應,應該符合滴定分析的一般要求,即反應完全,反應速度快;無副反應等。因此,必須根據具體情況,創造適宜的反應條件。
(1)根據平衡常數的大小判斷反應進行程度。一般K≥106或![]()
時,該反應進行得完全。
(2)反應速度快。一般可通過下列幾種方法增加反應速度。
①加催化劑。例如,用MnO-4氧化Fe2+時,加入少許Mn2+作為催化劑,可使反應迅速進行。
②升高溫度。例如,用MnO-4氧化C2O2-4時,室溫下反應進行得很慢,溫度升高到80℃時反應能夠很快地進行。
(3)無副反應。若用於滴定分析的氧化還原反應伴有副反應發生,必須設法消除。如果沒有抑制副反應的方法,反應就不能用於滴定。
按照氧化還原滴定中所用氧化劑的不同,將氧化還原法分為高錳酸鉀法、碘量法、重鉻酸鉀法等。本節主要討論高錳酸鉀法和碘量法。
二、高錳酸鉀法
(一)基本原理
![]()
在微酸、中性或弱鹼性溶液中,MnO-4被還原為棕色不溶物MnO2:
![]()
因MnO2能使溶液混濁,妨礙疑點觀察,所以高錳酸鉀法通常在較強的酸性溶液中進行。滴定時使用H2SO4控制酸度,避免使用HNO3(有氧化性)和HCL(有還原性)。
KMnO4還原為Mn2+的反應在常溫下進行得較慢。因此,滴定較難氧化的物質時,常需要加熱或加催化劑。例如,用KMnO4滴定C2O2-4時,即使在強酸性溶液中加熱的情況下,開始時反應也不會迅速進行。只有待最初加入的1-2滴KMnO4溶液的紫色退去後,溶液中就有了Mn2+,接著的反應能較快地進行。這種由於反應生成物本身引起的催化作用稱為自動催化作用。
高錳酸鉀法的指示劑是KMnO4本身,在100ml水中只要加1滴0.1mol.L-1KMnO4溶液就可以呈現明顯的紫紅色.而它的還原產物Mn2+則近無色.所以高錳酸鉀法不需另加指示劑。
KMnO4氧化性強,在強酸性溶液中可直接滴定一些還原性物質,如Fe2+,AsO3-3,NO-2,Sb3+,H2O2,C2O2-4,甲醛,葡萄糖和水楊酸等;也可間接滴定一些氧化性物質,如MnO2,PbO2,CrO-3,CLO-3等;還可測定一些能與氧化劑或還原劑起反應,但無氧化性或還原性的物質,如Ca2+,Ba2+,Zn2+和Cd2+等。例如,Ca2+能與C2O2-4形成沉澱溶於H2SO4中,然後用KmnO4溶液滴定生成H2C2O4,從而測出Ca2+的含量。
高錳酸鉀法的主要缺點是選擇性較差,標準溶液不夠穩定等。
(二)高錳酸鉀的應用示例——市售過氧化氫中H2O2含量的測定
在酸性溶液中,H2O2被KmnO4氧化。
2MnO-4+5H2O2+6H+→2Mn2+5O2+8H2o
氧化還原滴定同樣也要經過標準溶液的配製、標定和被測物質含量測定三個過程:
1.KMnO4標準溶液的配製
稱取約0.86g KMnO4加蒸餾水配成500ml0.01mol.L-1的標準溶液。加熱至沸,並保持微沸約1h。冷卻,放暗處約一周後用垂熔玻璃漏斗或玻璃絲過濾。將濾液移至棕色瓶內暗處保存。
2.KMnO4溶液濃度的標定
可用基準物質Na2CO3標定KMnO4溶液的濃度,反應式如下:
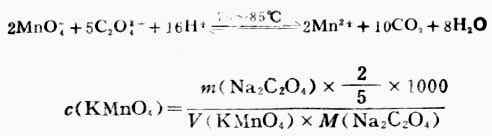
3.過氧化氫含量的測定
用移液管吸取市售過氧化氫1.00ml,放入250ml容量瓶中,稀釋25.00ml於錐形瓶中,加6ml3mol.L-1H2SO4,用KMnO4標準溶液滴定溶液呈粉紅色,設稀釋後H2O2的密度為1,H2O2的含量可按下式計算:
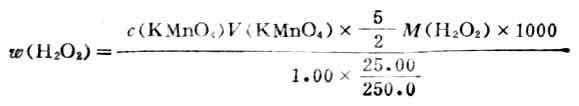
三、碘量法
(一)基本原理
碘量法是利用I2的氧化性和I-的還原性進行滴定的分析方法。
I2+2e-![]() 2I-
2I-![]() =0.535V
=0.535V
從![]() 值可知,I2是一種較弱的氧化劑,而I-是中等 強度的還原劑。低於
值可知,I2是一種較弱的氧化劑,而I-是中等 強度的還原劑。低於![]() 電對的還原性物質如S2-,SO2-3,AsO3-3,SbO3-3,維生素C等,能用I2標準溶液直接滴定,這種方法叫直接碘量法或碘滴定法。高於
電對的還原性物質如S2-,SO2-3,AsO3-3,SbO3-3,維生素C等,能用I2標準溶液直接滴定,這種方法叫直接碘量法或碘滴定法。高於![]() 電對的氧化性物質如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可將I-氧化成I2,再用Na2S2O3標準溶液滴定生成的I2。這種滴定方法叫間接碘量法或滴定碘量法。
電對的氧化性物質如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可將I-氧化成I2,再用Na2S2O3標準溶液滴定生成的I2。這種滴定方法叫間接碘量法或滴定碘量法。
1.直接碘量法
用直接碘量法來測定還原性物質時,一般應在弱鹼性、中性或弱酸性溶液中進行,如測定AsO3-3需在弱鹼性NaHCO3溶液中進行。
![]()
若反應在強酸性溶液中進行,則平衡向左移動,且I-易被空氣中的O2氧化:
4I-+O2+4H+→2I2+2H2O
如果溶液的鹼性太強,I2就會發生歧化反應:
![]()
I2標準溶液可用升華法製得的純碘直接配製。但I2具有揮發性和腐蝕性,不宜在天平上稱量,故通常先配成近似濃度的溶液,然後進行標定。由於碘在水中的溶解度很小,通常在配製I2溶液時加入過量的KI以增加其溶解度,降低I2的揮發性。直接碘量法可利用碘自身的黃色或加澱粉作指示劑,I2遇澱粉呈藍色。
2.間接碘量法
間接碘量法測定氧化性物質時,須在中性或弱酸性溶液中進行。例如,測定K2Cr2O7含量的反應如下:
Cr2O72-+6I-+14H+→2Cr3+3I2+7H2O
I2+2S2O22-→2I-+S4O2-6
若溶液為鹼性,則存在如下事反應:
I2+S2O22-+10OH-→8I-+2SO42-+5H2o
在強酸性溶液中,S2O2-3易被分解:
S2O22-+2H-→S↓+SO2+H2O
間接碘量法也用澱粉作指示劑,但它不是在滴定前加入,若指示劑加得過早,則由於澱粉與I2形成的牢固結合會使I2不易與Na2S2O3立即作用,以致滴定終點不敏銳。故一般在近終點時加入。應用碘量法除須掌握好酸度外,還應注意以下幾點:
(1)防止碘揮發。其辦法有:
①加入過量的KI,使I2變成I-。
②反應時溶液不可加熱。
③反應在碘量瓶中進行,滴定時不要過分搖動溶液。
(2)防止I-被空氣氧化。方法有:
①避免陽光照射。
②Cu2+、NO-2等能催化空氣對I-的氧化,應該設法除去。
③滴定應該快速進行。
(二)碘量法應用示例
1.維生素C含量測定
維生素C分子中含有烯二醇基,易被I2定量氧化成含二酮基的脫氫維生c,故可用直接碘量法測定定含量。
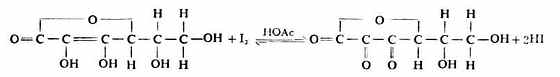
從上式可以看出,在鹼性條件下有利於反應向右進行,但維生素C的還原性很強,在鹼性環境中易被空氣中的O2氧化,故滴定時加一些HOAc使滴定在弱酸性溶液中進行,以減少維被空氣氧化所造成的誤差。操作如下:
(1)配製0.05mol.L-1I2標準溶液稱取6.5gI2和12.5gKI,置於小研缽中,加水少許,研磨至全部溶解後移入棕色瓶中,加水500ml,搖勻後避光陰涼處放置過夜。
(2)標定I2溶液濃度吸取25.00mlI2溶液置於250ml錐形瓶中,加水50ml,用標定過的Na2S2O3標準溶液滴定至淺黃色後,加入0.2%澱粉溶液2-4滴,繼續用Na2S2O3溶液滴定至藍色恰好退去,根據下式計算I2溶液的濃度。
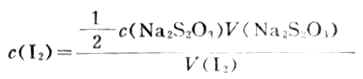
(3)維生素C含量的測定準確稱取約0.2g維生素C,放入錐形瓶中,加入新蒸過的蒸餾水50ml2mol.L-1HOAc使其溶解,加澱粉指示劑1ml,立即用I2標準溶液滴定至淺藍色,按下式計算維生素C的含量
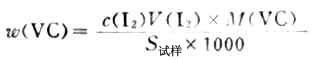
2.漂白粉中有效氯含量的測定
漂白粉的主要成分為CaCL(OCL)和CaCL2的混合物,前者與酸反應放出CL2具有漂白、殺菌和消毒作用,故稱之為有效氯。漂白粉的質量是以有效氯的含量為衡量標準的。
CoCl(OCl)+2H+→Ca2++HOCl+HCl
HOCl+HCl→Cl2+H2O
操作步驟如下:
(1)配製0.1mol.L-1Na2S2O3標準溶液 稱取約2.5g Na2S2O3溶於500ml新煮並冷卻的蒸餾水中,加少許Na2CO3,將溶液貯於棕色瓶中,在暗處放一周後標定其濃度.
(2)標定Na2S2O3標準溶液濃度準確稱取約0.15g在130-140℃烘乾的分析純K2Cr2O7,加水溶解後加過量KI和一定量的硫酸,加水稀釋至約100ml。用待標定的Na2S2O3溶液滴定至呈黃綠色後,滴加澱粉指示劑,繼續滴之下至溶液藍色消失而呈亮綠色為止。根據下式計算溶液的濃度:
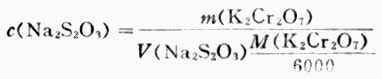
3.漂白粉中有效氯的測定 在漂白粉試樣的酸性溶液中,加入過量的KI,然後用Na2S2O3標準溶液滴定生成I2,從而計算出有效氯含量。
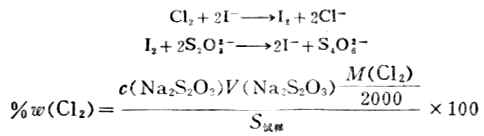
| 關於「醫用化學/氧化還原滴定法」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |