醫用化學/酸鹼滴定法
| 醫學電子書 >> 《醫用化學》 >> 滴定分析 >> 酸鹼滴定法 |
| 醫用化學 |
|
|
酸鹼滴定法是以酸鹼反應為基礎的滴定分析方法。利用該方法可以測定一些具有酸鹼性的物質,也可以用來測定某些能與酸鹼作用的物質。有許多不具有酸鹼性的物質,也可通過化學反應產生酸鹼,並用酸鹼滴定法測定它們的含量。因此,在生產和科研實踐中,酸鹼滴定法的應用相當廣泛。
一、滴定曲線與指示劑的選擇
(一)強鹼滴定強酸
強鹼滴定強酸時發生的反應為
![]()
上述反應的平衡常數為Kt為
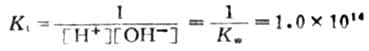
現以0.1000mol.L-1NaOH溶液滴定20.00mL,0.1000mol.L-1HCL.溶為例,討論滴定過程中溶液pH值的變化情況。
1.滴定前
溶液[H+]等於HCL的初始濃度:
[H+]=c(HCl)=0.100mol.L-1
pH=-lg[H+]=1.00
2.化學計量點前
溶液的[H+]決定於剩餘HCL的濃度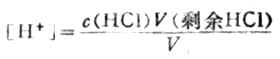
例如,當滴入18.00mLNaOH溶液時,有90%的HCL被中和,剩餘HCL物質的量為0.1000×20.00-0.1000×18.00=0.2000mmol,此時溶液的總體積為38.00mL,則溶液的[H+]為:
[H+]=0.2000/38.00=5.3*10-3(mol.L-1)
pH=-lg[H+]=-lg5.3*10-3=2.28
用類似的方法可求得當加入19.98mL NaOH時溶液的PH值為4.30。
3.化學計量點時
當加入20.00mLNaOH溶液時,HCL溶液被100%的中和,變成了中性的NaCL水溶液,故溶液的PH值由水的離解決定。
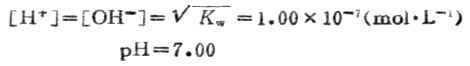
4.化學計量點後
溶液的PH值由過量的NaOH的量和溶液的總體積決定。即
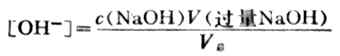
例如,當加入20.02ml NaOH溶液時, NaOH溶液過量0.02ml,溶液的總體積為40.02ml,則溶液的[OH-]為:
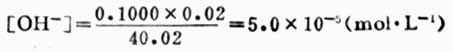
pOH=4.30
pH=14.00-4.30=9.70
根據上述方法可以計算出不同滴定點時溶液的PH值,部分結果列於表7-1。根據表中的數據作圖,即可得到強鹼滴定強酸的滴定曲線圖7-1中的a。
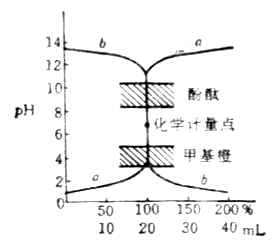
圖7-1 NaOH與HCL的滴定曲線
c(NaOH)=c(HCl) =0.1000mol.L-1
圖7-1
表7-1 用NaOH滴定HCL時溶液PH的變化(c(NaOh )=c(HCL)=0.1000mol.L-1)
| V(加入NaOH) ml |
被滴定HCL的百分含量% | V(剩餘HCL) ml |
V(過量NaOH) ml |
[H3O+] mol.L-1 |
PH |
| 0 | 0 | 20.00 | 1.00×10-1 | 1.00 | |
| 19.00 | 90.00 | 2.00 | 5.26×10-3 | 2.28 | |
| 19.80 | 99.00 | 0.20 | 5.02×10-4 | 3.30 | |
| 19.98 | 99.90 | 0.02 | 5.00×10-5 | 4.30 | |
| 20.00 | 100.00 | 0.00 | 1.00×10-7 |
7.00 |
|
| 20.02 | 100.1 | 0.02 | 2.00×10-10 | 9.70 | |
| 20.20 | 101.0 | 0.20 | 2.01×10-11 | 10.70 |
滴定曲線不僅說明了滴定時溶液PH值的變化方向,而且也說明了各個階段的變化速度。從圖中可以看出,曲線自左至右明顯分成三段。前段和後段比較平坦。溶液的PH值變化緩慢,中段曲線近乎垂直。在化學計量點附近PH值有一個突變過程。這種PH值突變稱之為滴定突躍,突躍所在的PH值範圍稱為滴定突躍範圍(常用化學計量點前後各0.1%的PH範圍表示,本例的突躍範圍是(4.30-9.70)。
最理想的指示劑應該能恰好在反應的化學計量點發生顏色變化,但在實際工作中很難使指示劑的變色范點和化學計量點完全統一。因此,指示劑的選擇主要以滴定的突躍範圍為依據,通常選取變色範圍全部或部分處在突躍範圍內的指示劑滴定終點,這樣產生的疑點誤差不會超過±0.1%。在上述滴定中,甲基橙(PH3.1-4.4)和酚酞(PH8.0-10.0)的變色範圍均有一部分在滴定的突躍範圍內,所以都可以用來指示這一滴定疑點此外,甲基紅、溴酚藍和溴百里酚藍等也可用作這類滴定的指示劑。
滴定突躍的大小與溶液的濃度密切相關。若酸鹼濃度均增大10倍,滴定突躍範圍將加寬2個PH單位;反之,若酸鹼濃度減小10倍,相應的突躍範圍將減小2個PH單位。可見濃度愈高突躍範圍越大,濃度越低突躍範圍越小,如果滴定時所用的酸鹼濃度相等並小於2×10-4mol .L-1,滴定突躍範圍就會小於0.4個PH單位,用一般的指示劑就不能準確地指示出終點。故將c≥2×10-4mol .L-1作為此類滴定能夠準確進行的條件。
強酸滴定強鹼的滴定曲線如圖7-1中的曲線b所示。指示劑的選擇及滴定反應用及其滴定條件等與前述滴定相似。
(二)強鹼滴定弱酸
在這類滴定反應中,由於強鹼完全離解而弱酸(HA)部分離解,故滴定反應及其反應常數Kt可表述為:
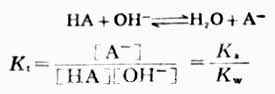
同強鹼滴定強酸的反應常數相比較,上述的Kt值要小得多,說明反應的完全程度較前類滴定差。且弱酸的Ka越大,反應的完全程度就越高。
現以0.1000 mol .L-1NaOH溶液滴定20.00ml0.1000 mol .L-1HOAc溶液為例討論這類滴定的特點。
NaOH 滴定HOAc 的滴定曲線如圖7-2所示。它和強鹼滴定強酸的滴定曲線不同。首先是曲線起始點的PH值為2.87而非1.00。這是由於HOAc 部分離解,其[H+]=√ KaC的結果。其次是起始點至化學計量點前這段曲線先較快地上升,後轉入平衡,在臨近終點時又較快地上升。這是HOAc –NaOAc緩衝對緩衝作用的表現。在滴定開始後,反應產生的OAc-抑制了HOAc的離解,使得[H+]有較快地下降,PH值上升較明顯。當[HOAc]/[ NaOAc]=1時,該緩衝體系的緩衝能力最大,曲線平坦。繼續加入NaOH,緩衝能力下降,PH值的上升速度又增加。近化學計量點時幾乎無緩衝作用,故PH值上升較快。第三是化學計量點時溶液的PH=8.73,這是NaOAc水解的結果。此外,在化學計量點附近產生的滴定突躍範圍明顯小於強鹼滴定強酸所產生的突躍範圍。在化學計量點後,過量的NaOH存在抑制了鹽的水解,溶液的PH值由過量的NaOH決定。故滴定曲線與強鹼滴定強酸的滴定曲線相似。
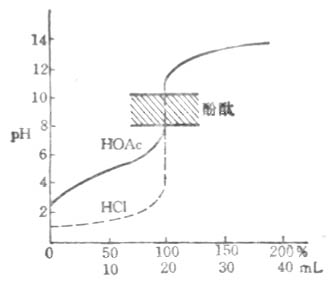
圖7-2 用NaOH滴定HOAc的滴定曲線c
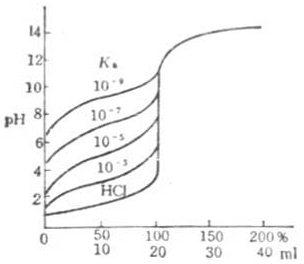
圖7-3 NaOH滴定各種不同強並能弱
(NaOH)=c(HOAc)=0.100mol.L-1c(NaOH)=c(HB)=0.1000mol.L-1
根據強鹼滴定弱酸時PH值的變化,一般選用變色範圍處於鹼性範圍內的指示劑。較常用的有酚酞和百里酚藍等。在實際應用時,仍必需依據滴定的突躍範圍大小來決定指示劑。
滴定的突躍範圍不僅與酸鹼濃度有關,還受到弱酸強度的影響。因此在進行此類滴定時必須考慮這兩個因素。圖7-3是用0.1000mol .L-1NaOH溶液滴定20.00ml0.1000 mol .L-1各種不同強度弱酸的滴定曲線.當弱酸的濃度一定時,Ka越大,滴定的突躍範圍越大;Ka越小滴定的突躍範圍就越小。當c(HB)=0.1000mol .L-1時,Ka≤10-9,已無明顯的滴定突躍,也無法用一般的指示劑確定反應終點。只有當cKa≥10-8時可用指示劑判別滴滴定突躍(約0.4個PH單位),所以常將c Ka≥10-8作為弱酸能被強鹼準確滴定的先決條件。
(三)強酸滴定弱鹼
強酸滴定弱鹼與強鹼滴定弱酸相類似,現以0.1000mol .L-1HCL溶液滴定20.00ml0.1000 mol .L-1氨水為例,說明滴定過程中PH值的變化及指示劑的選擇.上述滴定的反應和反應常數可表述為:
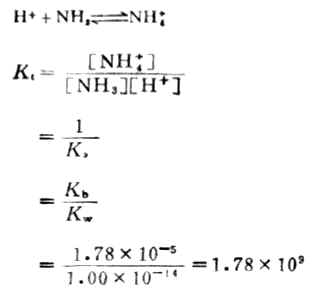
該反應的反應常數較大,可以預計反應能較完全進行.各滴定點PH值可通過計算求得滴定曲線如圖7-4。由圖可以看出,強酸滴定弱鹼時,滴定突躍在酸性範圍內,化學計量點時,溶液的PH值小於7.00,對於該例來說,化學計量點時溶液的PH值為5.28,突躍範圍是6.25-4.30。對於這種類型滴定所選指示劑的變色範圍應在酸性範圍內。甲基紅或溴甲酚綠是這類滴定中常用的指示劑。
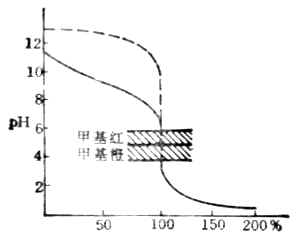
圖7-4 用HCl滴定NH3.H2O的滴定曲線c(HCl)=c(NH3.H2O)
=0.1000mol.L-1
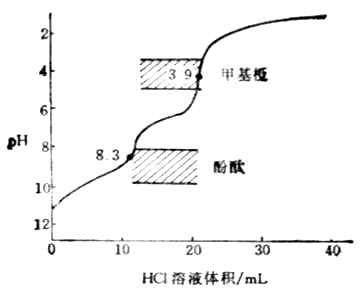
圖7-5 HCl滴定Na2CO3的滴定的曲線
在強酸滴定弱鹼時,弱鹼的Kb值與濃度也應滿足cKb≥10-8的條件,方可進行準確滴定。
(四)多元酸鹽的滴定
能夠用於滴定的多元酸鹽一般為強鹼弱酸鹽,因為它們水解使溶液呈鹼性,故可用強酸進行滴定。
Na2CO3是二元弱酸H2CO3的鈉鹽,由於H2CO3的兩級離解常數都很小,CO2-3、HCO-3水解後溶液的鹼性足以用HCL直接滴定。因此,常將Na2CO3作為基準物質標定HCL溶液的濃度,工業鹼純度的測定也是基於它與HCL反應。
滴定反應分兩步進行,在第一步時Na2CO3全部轉變為Na2CO3。
Na2CO3+HCl→NaHCO3+NaCl
所以到達第一化學計量點時,溶液的PH值主要由NaHCO3決定,可按下式計算溶液的酸度:
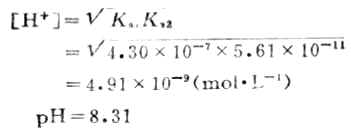
繼續用HCL溶液滴定時,發生第二步滴定反應,NaHCO3全部變成H2CO3而達到第二化學計量點:
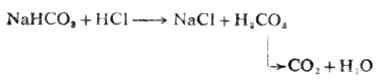
這時的溶液為H2CO3的飽和溶液,在通常的情況下為0.04mol.L-1,則第二化學計量點時溶液的[H+]為:
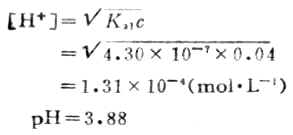
滴定過程中溶液的PH值的變化如圖7-5所示。
在PH為8.31和3.88附近各有一個滴定突躍。前一個突躍不大明顯,這是由於第一步滴定反應的產物NaHCO3具有一定的緩衝作用以及碳酸的Ka1和Ka2相差不太大的緣故。這步滴定的指示劑常選用酚酞。第二個突躍範圍較明顯,通常用甲基橙指示劑。終點前溶液中H2CO3能與HCO-3組成緩衝體系,終點不易掌握。故在實際操作時,當反應接近第二化學計量點前,採用加熱或不斷振搖的辦法驅逐溶液中的CO2,這樣可以得到較為準確的滴定終點。
二、酸鹼滴定法的應用實例
在實際工作中常用的酸溶液主要是HCL溶液,有時也用H2SO4標準溶液。常用的鹼溶液是NaOH標準溶液。由於這些試劑價廉易得,加之酸鹼滴定法操作簡便,分析速度快和結果準確。因而在工農業生產及科學實踐中得到廣泛應用。在臨床檢驗上常用以測定尿液、胃液及其他體液的酸度。在衛生分析方面也常用以測定各種食品的酸度等。下面介紹一些實例。
(一)食醋中總酸度的測定
食醋約含3%-5%的HOAc,此外,還含有少量其他有機酸。當用NaOH滴定量,所得結果為食醋的總酸度,通常用含量較多的HOAc來表示。滴定反應如下:HOAc+NaOH→NaOHc+H2O
達到化學計量點時溶液顯鹼性,因此常選酚酞作為指示劑。
操作步驟:用移液管吸取Vml食醋置於250ml容量瓶中,用蒸餾水稀釋至刻度,充分搖勻。再用移液管吸出25.00ml放在250ml錐形瓶中,加酚酞指示劑2滴,用NaOH標準溶液滴定,不斷振搖,當滴至溶液呈粉紅色且在半分鐘內不退色即達終點。重複操作2-3次,按下式計算食醋中HOAc的質量分數。
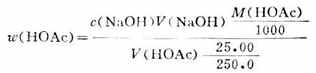
(二)氧化鎂含量的測定
因為固體氧化鎂難溶於水,所以在測定試樣中氧化鎂含量(質量分數)時,採用剩餘量滴定法。即先稱取一定量的待測樣品溶於過量且已知準確體積的酸標準溶液中,待反應完全後,用標準鹼溶液滴定剩餘的酸,反應如下:
MgO+H2SO4(過量)→MgSO4+H2O
2NaOH+H2SO4(乘余) →H2SO4+2H2O
操作步驟:稱取約1g(准至0.1mg)左右樣品置於錐形瓶中,加入c(H2SO4)=0.5000mol.L-1標準溶液50.00ml,振蕩使其溶解,加入甲基橙指示劑2滴,用0.1000mol.L-1NaOH標準溶液滴定剩餘的硫酸。當溶液由紅變為橙色即為終點。
加入硫酸的總量為:
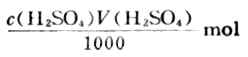
與NaOH反應硫酸的量為:
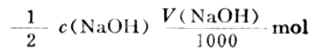
氧化鎂的質量分數為:
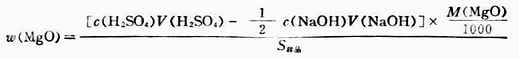
| 關於「醫用化學/酸鹼滴定法」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |