醫用化學/配合滴定法
| 醫學電子書 >> 《醫用化學》 >> 滴定分析 >> 配合滴定法 |
| 醫用化學 |
|
|
在化學分析中,常利用金屬離子與某些配合劑生成配合物的反應來測定某成分的含量。利用配合反應滴定分析方法配合滴定法。能用於配合滴定的配合劑有很多種,其中最常用的是氨羧配合劑,而氨羧配合劑中以EDTA應用最廣。
一、EDTA配合沆定的基本原理
(一)EDTA配合滴定的基本原理
EDTA(用H4Y表示)是一個多元酸,在溶液中以H4Y,H3Y-,HY3-,Y4-等形式存在。其中Y4-能與多種金屬離子直接配合生成穩定的配合物,配合比為1:1。
金屬離子與EDTA形成的配合物的穩定性常用穩定常數的對數表示。EDTA與金屬離子形成配合物的反應如下(為簡單起見略去電荷):
![]()
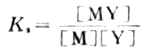 (7-6)
(7-6)
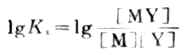 (7-7)
(7-7)
Ks或lgKs越大,配合物越穩定。表7-2列舉了一些常見金屬離子與EDTA形成配合物的lgKs值,
表7-2 EDTA金屬離子配合離子lgKs值
| 金屬離子 | 配合離子 | lgKs | 金屬離子 | 配合離子 | lgKs | 金屬離子 | 配合離子 | lgKs |
| Na+ | NaY3- | 1.66 | Fe2+ | FeY2- | 14.33 | Cu2+ | CuY2- | 18.7 |
| Li+ | LiY3- | 2.79 | Al3+ | AlY- | 16.11 | Hg2+ | HgY2- | 21.8 |
| Ag+ | AgY3- | 7.32 | Co2+ | CoY2- | 16.31 | Sn2+ | SnY2- | 22.1 |
| Ba2+ | BaY2- | 7.78 | Cd2+ | CdY2- | 16.40 | Bi3+ | BiY- | 22.8 |
| Mg2+ | MgY2- | 8.64 | Zn2+ | ZnY2- | 16.40 | Cr3+ | CrY- | 23.0 |
| Ca2+ | CaY2- | 11.0 | Pb2+ | PbY2- | 18.30 | Fe3+ | FeY- | 24.23 |
| Mn2+ | MnY2- | 13.8 | Ni2+ | NiY2- | 18.56 | Co3+ | CoY- | 36.0 |
式(7-6)中的[Y]是指平衡時的[Y4-],不包括EDTA其他存在形式,故稱Ks為配合物的絕對常數,它與溶液的酸度無關。表7-2中所列數據均為絕對穩定常數。由於EDTA是弱酸性的配合劑,因此溶液的酸度對EDTA配合物的穩定性有很大的影響。
1.酸度的影響
酸度的影響可用下式表示:
![]()
可見溶液的酸度越高,[Y4-]越低,越不利於配合滴定的進行;溶液的酸度越低[Y4-]越高,配合滴定進行得越完全。EDTA溶液中除了Y4-外,還存在其他形式。設EDTA總濃度為[Y]總,則
[Y]總=[H4Y]+[HY-]+[HY2-]+[HY3-]+[Y4-](7-8)
[Y]總與[Y4-]之間存在著一定的比例關係。
[Y]總=αH.[Y-4]
αH=[Y]總/[Y4-]
比例係數aH叫做酸效應係數,它是隨酸度的增大而增大,aH可以從EDTA的各級電離常數和溶液中[H+]計算出來。
將式(7-9)代入式(7-6)可得
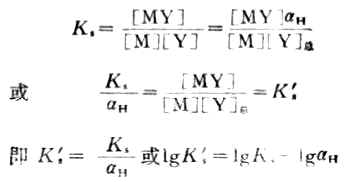 (7-10)
(7-10)
式中Ks' 是考慮了酸效應的穩定常數,叫做條件穩定常數或表觀穩定常數,在不同酸度下,KS是不變的,但由於aH隨酸度增大而增大,故Ks'則隨酸度的增大而減小。在配合滴定中,要求反應量的完成,Ks'越大,反應進行得越完全。
如被測金屬離子的初始濃度為0.02mol.L-1,當反應完全時,金屬離子基本都配合成MY,即得[MY]=1.0×10-2mol.L-1,設測定的允許誤差為0.1%,則滴定達到平衡時,
[M=[Y]≤1.0*10-2*0.1%=1.0*10-5(mol.L-1)
將這一關係代入式(7-10)則得
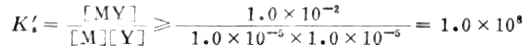
或lgKs'≥8 (7-11)
可見MY配合物的 Ks'必須等於或大於1.0×108,才能滿足滴定誤差小於0.1%的要求
由式(7-10)可得
lgαH≤lgKs-8 (7-12)
利用上式,再根據7-3可以求得滴定各種多金屬離子所允許的最低PH值。
7-3 不同PH時EDTA的lgaH
| pH | lgaH | pH | lgaH | pH | lgaH |
| 0 | 21.18 | 4 | 8.44 | 8 | 2.26 |
| 1 | 17.20 | 5 | 6.45 | 9 | 1.28 |
| 2 | 13.52 | 6 | 4.65 | 10 | 0.45 |
| 3 | 10.60 | 7 | 3.32 | 11 | 0.07 |
在滴定過程中也應控制一定的酸度,因為EDTA在滴定中不斷有H+釋放出來,使溶液的PH值降低。例如用EDTA二鈉溶液滴定Ca2+時,其反應式如下:
![]()
因此配合滴定常需用緩衝控制酸度。
2.其他配合劑的影響
溶液中存在其他配合劑時的影響用下式表示:
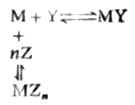
Z代表其他配合劑,n為Z的係數。由於其他配合劑的存在,降低了金屬離子的濃度,使平衡向左移動。配合滴定中常常利用這個原理消除干擾離子。例如,用EDTA滴定Mg2+和Cd2+、Zn2+混合液中的Mg2+時,可在滴定前向混合液中加入KCN,使Cd2+和Zn2+與CN-形成穩定的[Zn(CN)4]2-和[Cd(CN)4]2-(Mg2+不與CN-配合),從而消除了Cd2+和Zn2+對滴定的干擾。這種消除干擾的作用叫掩蔽作用,起掩蔽作用的配合劑叫掩蔽劑。
(二)金屬指示劑
配合滴定中指示終點的方法很多,其中最重要、應用最多的是金屬指示劑。它常常是一種配合劑,能與金屬離子形成可溶於水的有色配合物。

在滴定前,溶液中金屬指示劑與金屬離子形成有色配合物,溶液的顏色就是這種酏合物的顏色。滴不定期開始後,EDTA與溶液中自由金屬離子配合。滴定接近並達到終點時,與指示劑配合的金屬離子濃度劇烈降低,MIn轉變為In,溶液的顏色由MIn的顏色轉變為指示劑In的顏色。
值得注意的是金屬指示劑與金屬離子形成的配合物要有適當的穩定性。穩定性太低,配合物易離解,會使終點提前出現。穩定性太高,稍過終點時,EDTA仍不能奪取MIn中的金屬離子,就無法指示終點,使終點出現過遲。
常見的金屬指示劑有鉻黑T(EBT)、鈣試劑等。現以鉻黑T為例進行介紹。鉻黑T(用NaH2In表示)是一個具有弱酸性酚羥基的有色配合劑,在不同的酸度下為不同的顏色。
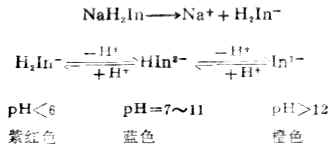
在PH<6或PH>12時,游離的指示劑與形成金屬離子配合物的顏色沒有明顯的區別,在PH=7~11的溶液里指示劑顯藍色,而與金屬離子生成的配合物為紅色,顏色有極明顯的差別。所以用鉻黑T作指示劑時,PH值應控制在7~11的範圍內,最適宜的PH值為9~10.5。例如,用EDTA滴定Mg2+時,先在被測溶液中加入NH+4-NH3.H2O緩衝溶液,將PH值控制在10左右,然後加鉻黑T作指示劑數滴,用0.02mol.L-1EDTA標準溶液滴定。
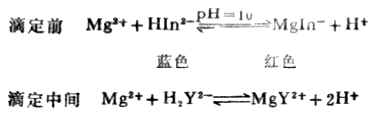
滴定終點時,由MgIn-的紅色轉變為HIn2-的藍色。
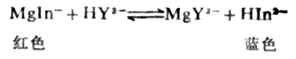
在滴定過程中,顏色的變化為:紅色→紫色→藍色。當溶液的顏色由紅色轉變成紫色時,說明滴定已接近終點,再稍許滴定幾滴即達到終點。
二、EDTA配合滴定應用示例——水的總硬度測定
水的總硬度是指水中Ca2+、Mg2+的總含量。水中鈣鎂酸式碳酸鹽形成的硬度稱為暫時硬度,鈣鎂的其他鹽類如硫酸鹽、氯化物等形成的硬度稱為永久硬度。暫時硬度和永久硬度的總和稱為總硬度,其單位用每升水中含CaO或CaCO3的毫克數來表示,可寫成CaOmg.L-1或CaCO3 mg.L-1。
操作步驟如下;
(一)配製0.01 mol.L-1的EDTA標準溶液
稱取約0.19gEDTA二鈉,用蒸餾水配成500ml溶液,然後用MgCO3作基準物質標定其濃度。
(二)EDTA溶液的濃度的標定
稱取在110℃烘乾過的基準物質MgCO30.21g(准至0.1mg),置於燒杯中,用稀鹽酸溶解後配成250ml溶液,吸取25.00ml於錐形瓶中,加濃氨水至溶液呈鹼性,再加5mlPH約為10的NH+-NH3.H2o 緩衝溶液,加鉻黑T指示劑,用EDTA標準溶液滴定至溶液呈藍色.
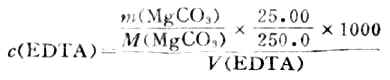
(三)水的總硬度測定
取水樣50ml,加入5mlPH=10的NH+-NH3.H2O 緩衝溶液,再加鉻黑T指示劑數滴,用0.01ml mol.L-1的EDTA標準溶液滴定至溶液呈藍色。按下式計算出每升水中CaCO3的含量作為總硬度(單位mg.L-1)。
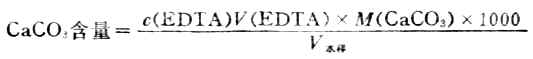
| 關於「醫用化學/配合滴定法」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |