SH2結構域
| A+醫學百科 >> SH2結構域 |
 |
|||||||||
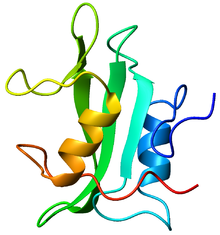
| SH2結構域的晶體結構:該結構包含一股大β摺疊(綠色)兩側連著兩股α螺旋(橙色及藍色)[1] | |||||||||
| 鑒定 | |||||||||
| 標誌 | SH2 | ||||||||
| Pfam(蛋白家族查詢站) | PF00017 | ||||||||
| InterPro(蛋白數據整合站) | IPR000980 | ||||||||
| SMART | SH2 | ||||||||
| PROSITE(蛋白數據站) | PDOC50001 | ||||||||
| SCOP(蛋白結構分類數據站) | 1sha | ||||||||
| OPM蛋白(膜蛋白方向) | 1xa6 | ||||||||
| CDD(保守域數據站) | cd00173 | ||||||||
|
|||||||||
SH2結構域(英語:Src Homology 2 domain,Src同源2結構域)是癌蛋白Src[2]以及許多其它細胞內信號轉導蛋白[3]上的一個保守的結構域。那些含SH2結構域的蛋白質可以對接到其它蛋白中的磷酸化酪氨酸殘基上。SH2結構域往往存在於幫助受體酪氨酸激酶通路信號轉導的銜接蛋白中[4]。
目錄 |
介紹
蛋白質-蛋白質互作在細胞生長與發育過程中起到重要的作用。作為蛋白質亞單位的模塊化的結構域通過識別短肽序列的方式調控這些蛋白質互作。SH2結構域就是比較著名的結構域之一。SH2結構域在細胞通訊之中起到了重要作用。這一結構域長約100個胺基酸,存在於111種人體蛋白質中[5]。究其結構,該結構域包含兩股α螺旋及七股β鏈。研究顯示其與磷酸化的酪氨酸殘基有較高的親和力且已知其可以識別一段模體肽鏈中3~6個胺基酸序列。
結合與磷酸化
SH2結構域通常結合到靶蛋白中較長肽基序中的磷酸化酪氨酸殘基上,SH2結構域代表了最大一類已知磷酸酪氨酸識別結構域[6][7]。
蛋白質中的磷酸化酪氨酸殘基往往存在於信號轉導通路中,這一信號由酪氨酸激酶產生。通過這種方式,由酪氨酸激酶所致的底物磷酸化行使了開關的作用,誘發含SH2結構域的蛋白結合上來。結合到SH2結構域上的多種含酪氨酸的短線性基序在多種高等真核生物間都很保守[8]。在真核生物進化過程中,酪氨酸激酶與SH2結構域同時出現,證明了它們之間的緊密聯繫性。
多樣性
SH2結構域並不存在於單細胞的酵母之中,而存在於單細胞生物與多細胞的動物之間的邊緣生物中,如社會性變形蟲盤基網柄菌[9]。
前人做過詳盡的對人類及小鼠中SH2結構域的生物信息學檢測,發現人類基因組編碼出的115種蛋白質中包含了120個SH2結構域[10],這意味著SH2結構域的進化速度很快。
現已解析出大量SH2結構域的結構,亦構建出敲除含SH2結構域的那些蛋白質的基因敲除鼠。可在這個網站上找到這些敲除小鼠的信息[11]。
功能
SH2結構域的功能是特異性識別酪氨酸殘基的磷酸化狀態,從而使包含SH2結構域的蛋白質可以定位到其它蛋白的磷酸化酪氨酸位點上。這一過程構成了信號穿過細胞膜轉導入細胞的基本事件,細胞太空間的信號被受體「感知」,繼而在胞內空間轉化為另一種化學形式,如磷酸化的酪氨酸。酪氨酸的磷酸化狀態激活了串聯的蛋白-蛋白交互作用,其中包含SH2結構域的蛋白質被召集到磷酸化酪氨酸位點上。這一過程激活了一系列最終導致基因表達改變等細胞響應下游事件。
最初是在癌蛋白Src與Fps之中鑒定出了SH2結構域,該結構域長度約為100個胺基酸殘基。通過序列特異性及嚴格依賴磷酸化的方式與包含磷酸酪氨酸的靶肽段結合,從而行使胞內信號調控模塊的功能。
例子
蛋白質中包括SH2結構域的人類基因有:
- ABL1、ABL2
- BCAR3、BLK、BLNK、BMX、BTK
- CHN2、CISH、CRK、CRKL、CSK
- DAPP1
- FER、FES、FGR、FRK、FYN
- GRAP、GRAP2、GRB10、GRB14、GRB2、GRB7
- HCK、HSH2D
- INPP5D、INPPL1、ITK、 JAK2、LCK、LCP2、LYN
- MATK、NCK1、NCK2
- PIK3R1、PIK3R2、PIK3R3、PLCG1、PLCG2、PTK6、PTPN11、PTPN6、RASA1
- SH2B1、SH2B2、SH2B3、SH2D1A、SH2D1B、SH2D2A、SH2D3A、SH2D3C、SH2D4A、SH2D4B、SH2D5、SH2D6、SH3BP2、SHB、SHC1、SHC3、SHC4、SHD、SHE
- SLA、SLA2
- SOCS1、SOCS2、SOCS3、SOCS4、SOCS5、SOCS6、SOCS7
- SRC、SRMS
- STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6
- SUPT6H、SYK
- TEC、TENC1、TNS、TNS1、TNS3、TNS4、TXK
- VAV1、VAV2、VAV3
- YES1、 ZAP70
參考文獻
- ↑ PDB 1lkk; Tong L, Warren TC, King J, Betageri R, Rose J, Jakes S. Crystal structures of the human p56lck SH2 domain in complex with two short phosphotyrosyl peptides at 1.0 A and 1.8 A resolution. J. Mol. Biol.. March 1996, 256 (3): 601–10. doi:10.1006/jmbi.1996.0112. PMID 8604142.
- ↑ Sadowski I, Stone JC, Pawson T. A noncatalytic domain conserved among cytoplasmic protein-tyrosine kinases modifies the kinase function and transforming activity of Fujinami sarcoma virus P130gag-fps. Mol. Cell. Biol.. December 1986, 6 (12): 4396–408. PMID 3025655. PMC 367222.
- ↑ Russell RB, Breed J, Barton GJ. Conservation analysis and structure prediction of the SH2 family of phosphotyrosine binding domains. FEBS Lett.. June 1992, 304 (1): 15–20. doi:10.1016/0014-5793(92)80579-6. PMID 1377638.
- ↑ Koytiger G, Kaushansky A, Gordus A, Rush J, Sorger PK, Macbeath G. Phosphotyrosine signaling proteins that drive oncogenesis tend to be highly interconnected. Mol. Cell Proteomics. January 2013. doi:10.1074/mcp.M112.025858. PMID 23358503.
- ↑ PMID 22155787(PubMed)
本引用來源將會在數十分鐘後自動完成。您可以檢查英文對應模板或手動擴充 - ↑ Pawson T, Gish GD, Nash P. SH2 domains, interaction modules and cellular wiring. Trends in Cell Biology. December 2001, 11 (12): 504–11. doi:10.1016/S0962-8924(01)02154-7. PMID 11719057.
- ↑ Huang H, Li L, Wu C, Schibli D, Colwill K, Ma S, Li C, Roy P, Ho K, Songyang Z, Pawson T, Gao Y, Li SS. Defining the specificity space of the human SRC homology 2 domain. Molecular & Cellular Proteomics : MCP. April 2008, 7 (4): 768–84. doi:10.1074/mcp.M700312-MCP200. PMID 17956856.
- ↑ PMID 18828911(PubMed)
本引用來源將會在數十分鐘後自動完成。您可以檢查英文對應模板或手動擴充 - ↑ Eichinger L, Pachebat JA, Glöckner G, et al.. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC1352341/ The genome of the social amoeba Dictyostelium discoideum]. Nature. May 2005, 435 (7038): 43–57. doi:10.1038/nature03481. PMID 15875012. PMC 1352341.
- ↑ Liu BA, Jablonowski K, Raina M, Arcé M, Pawson T, Nash PD. The human and mouse complement of SH2 domain proteins-establishing the boundaries of phosphotyrosine signaling. Molecular Cell. June 2006, 22 (6): 851–68. doi:10.1016/j.molcel.2006.06.001. PMID 16793553.
- ↑ Nash P, Pawson T, Jablonowski K. the SH2 domain. The University of Chicago [2008-11-08].
外部連結
- Li S. SMALI site. University of Western Ontario [2009-01-08].
- Mayer BJ. SH2 Domain Database link page. University of Connecticut. 2007-10-23 [2009-01-08].[失效连结]
- The Nash Lab. the SH2 domain. The Nash Lab [2012-12-13].
- The Pawson Lab. SH2 Domain. Mount Sinai Hospital, Ontario, Canada [2009-01-08].
- Rose T, Waksman G. SH2 domains: Introduction and Overview. Washington University School of Medicine. 2000-02-29 [2009-01-08].
|
|||||||||||||||||||||||
參考來源
| 關於「SH2結構域」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |