醫用化學/電極電位的應用
| 醫學電子書 >> 《醫用化學》 >> 氧化還原與電極電位 >> 電極電位的應用 |
| 醫用化學 |
|
|
一、判斷氧化還原反應自發進行的方向
電池反應都是自發進行的氧化還原反應。因此電池反應的方向即氧化還原反應自發進行的方向。判斷氧化還原反應進行的方向時,可將反應拆為兩個半反應,求出電極電位。然後根據電位高的為正極起還原反應,電位低的為負極起氧化反應的原則,就可以確定反應自發進行的方向。如果兩個電對的![]() 值相差較大(即Eφ),濃度的變化對電位的影響不大,不致於使反應改變方向。因此,當Eφ<0.2V 時,即使不處於標準狀態,也可直接用
值相差較大(即Eφ),濃度的變化對電位的影響不大,不致於使反應改變方向。因此,當Eφ<0.2V 時,即使不處於標準狀態,也可直接用![]() 值的大小確定反應方向。否則,必須考慮濃度和酸度的影響,用能斯特方程式計算出電對的
值的大小確定反應方向。否則,必須考慮濃度和酸度的影響,用能斯特方程式計算出電對的![]() 值,用E>0作為判斷確定反應進行的方向,若E>0,正向反應能自發進行;E<0,正向反應不能自發進行,其逆向反應能自發進行。
值,用E>0作為判斷確定反應進行的方向,若E>0,正向反應能自發進行;E<0,正向反應不能自發進行,其逆向反應能自發進行。
例9 判斷298K時下列反應進行的方向:
![]()
解:將上述反應寫成兩個半反應,並查出它們的標準電極是位:
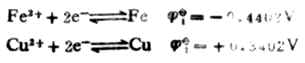
標準電動勢為:Eφ=![]()
2-![]()
1=0.4402-(-0.4402)
=0.7804(V)。
因為Eφ<0.2V,可直接用![]()
值判斷反應進行的方向。![]()
2>![]()
1,表明Cu2+是比Fe2+更強的氧化劑,Fe是比Cu更強的還原劑所以上述反應可自發地向右進行。
為了證明這個結論的正確性,我們可以按非標準態的電池反應計算電動勢。
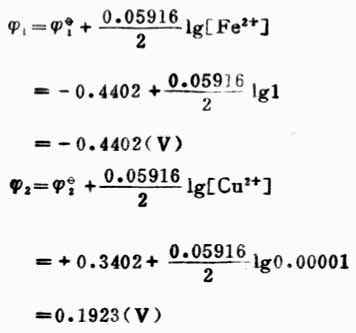
電池電動勢為:E=![]()
2-![]()
1=0.1923-(-0.4402)
=0.6325(V)
因為E<0,上述反應可自發地向右進行。
例10 判斷298K時反應
![]()
當[HAsO2]=[H3AsO4]=1mol.L-1,[I-]=1mol.L-1,在中性和酸性([H+]=1mol.L-1)溶液中反應進行的方向。
解:將上述反應寫成兩個半反應,並查出它們的標準電極電位:
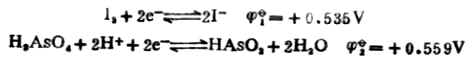
在中性溶液中,[H+]=1.0*10-71mol.L-1。
![]()
1=![]()
1=+0.535V
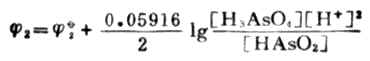
=0.559+0.059161g[H+]
=0.559+0.059161g10-7
=0.559+0.414
=0.145(V)
因為 ![]()
1![]()
2,所以I2是比H3AsO4更強的氧化劑,而HAsO2是比I-更強的還原
劑。因而上述反應能自發地向右進行。即
HAsO2+I2+2H2O→H3AsO4+2I-+2H+
當溶液中氫離子濃度為1mol.L-1時,
![]()
1=![]()
1=+0.535V
![]()
2=![]()
2=+0.559V
因為![]()
1<![]()
2,所以H3AsO4是比I2更強的氧化劑,而I-更強的還原劑。因而上
述反應能自發地向右進行。即
H3AsO4+2I-+2H+→HAsO2+I2+2H2O
二、判斷氧化還原反應進行的程度
氧化還原反應屬可逆反應,同其他可逆反應一樣,在一定條件下也能達到平衡。隨著反應不斷進行,參與反應的各物質濃度不斷改變,其相應的電極電位也在不斷變化。電極電位高的電對的電極電位逐漸降低,電極電位低的電對的電極電位逐漸升高。最後必定達到兩電極電位相等,則原電池的電動勢為零,此時反應達到了平衡,即達到了反應進行的限度。利用能斯特方程式和標準電極電位表可以算出平衡常數,判斷氧化還原反應進行的程度。若平衡常數值很小,表示正向反應趨勢很小,正向反應進行得不完全;若平衡常數值很大,表示正向反應可以充分地進行,甚至可以進行到接近完全。因此平衡常數是判斷反應進行程度的標誌。
氧化還原K與反應中兩個電對的標準電極電位的關係為:
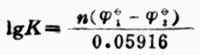 (6-4)
(6-4)
式中,n—反應中得失電子數;
![]()
1—正反應中作為氧化劑的電對的標準電極電位;
![]()
2—正反應中作為還原劑的電對的標準電極電位。
由式(6-4)可見,![]()
1與![]()
2之差值愈大,K值也愈大,反應進行得也愈完全。
例11 計算下列反應在298K時的平衡常數,並判斷此的以應進行的程度。
![]()
解: 電極反應Ag++e-→Ag![]() 1=+0.7996V
1=+0.7996V
Fe2+→Fe3++e-![]() 2=+0.77V
2=+0.77V
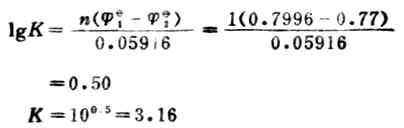
此反應平衡常數很小,表明此正反應進行得很不完全。
例12 計算下列反應的298K時的平衡常數,並判斷此反應進行的程度。
![]()
解:
電極反應 Cr2O72-+14H++6e-+→2Cr3+7H2O
![]()
1=+1.33V
2I-→I2+2e- ![]()
1=+0.535V
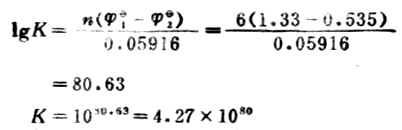
此反應的平衡常數很大,表明此正反應能進行完全,實際上可以認為能進行到底。
例13 向0.45mol.L-1鉛鹽溶液中加錫,發生下列反應,
![]()
計算298K時反應的平衡常數,達到反應限度時溶液中Pb2+濃度為多少。
解:
電極反應:Pb2++2e-→Pb![]()
1=-0.1263V
Sn→Sn2++2e-![]()
2=-0.1364V
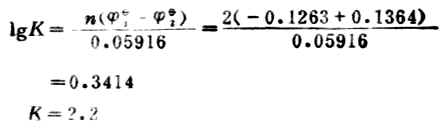
設平衡(達到反應限度)時溶液中Pb2+濃度為χmol.L-1。
![]()
χ 0.45-χ
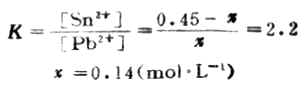
即達到反應限度時溶液中Pb2+濃度為0.14mol.L-1。
三、 電位法測定溶液的PH值
如果有H+或OH-參加電極反應,則H+濃度對電極電位會有影響。把這個電極作為指示電極和一個參比電極組成電池,測定電池電動勢,就可以算出指示電極的電位,溶液中H+濃度即溶液的PH值。
所謂指示電極就是這一電極的電位與溶液中某種離子濃度的關係符合能斯特方程式。從它所顯示的電位可以推算出溶液中這種離子的嘗試通常把這種電極看作是待測離子的指示電極。測定溶液的PH值,就是測定溶液中H+濃度,因此要採用氫離子指示電極。所謂參比電極是指電極電位穩定且已知其準確數值的電極。
(一)參比電極
飽和甘汞電極的構造如圖6-4所示。飽和甘汞電極由兩個玻璃套管組成。內管上部為汞,連接電極引線。在汞的下方充填甘汞(HgCL2)和汞的糊狀物。內管的下端用石棉或脫脂棉塞緊。外管上端有一個側口,用以加入飽和氯化鉀溶液,不用時側口用橡皮塞塞緊。外管下端有一支管,支管口用多孔的素燒瓷塞緊,外邊套以橡皮帽。使用時摘掉橡皮帽,使與外部溶液相通。
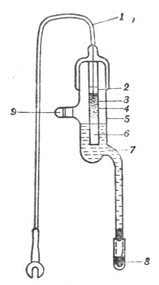
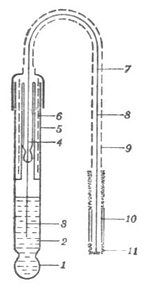
圖6-5 玻璃電極
圖6-4 飽和甘汞電極1.玻璃球膜,2.緩
1.電極引線 2.玻璃管,3.汞,4.甘示糊 沖溶液,3.銀-氯化銀電極,
(Hg2Cl2和Hg研成的糊),5.玻璃外套,6. 4.電極導線,5.玻璃管,6.
石棉或紙漿,7.飽和KCl溶液,8.素燒瓷 靜電隔離層,7.電極導線,8
,9.小橡皮塞 .金屬隔離罩,10.塑料絕緣
線,11.電極接頭
飽和甘汞電極的組成式為:
KCl(飽和),Hg2Cl2(固),Hg(l)│Pt
其電極反應式為:
![]()
根據能斯特方程式,298K時電極電位為:
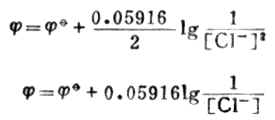
式中![]()
值是定值,在飽和溶液中[CL-]也為定值,故飽甘汞電極的電極電位為定值,298k 時為0.2412V。
飽和甘汞電極的電位穩定,再現性好,而且裝置簡單,容易保養,使用方便,因此廣泛地用作參比電極。
(二)指示電極
常用的PH指示電極為玻璃電極。
玻璃電極的構造如圖6-5所示。在玻璃管的下端連接一個厚度為50-100um的半球形玻璃膜。膜內盛有0.1mol .L-1鹽酸稱參比溶液。在參比溶液中插入一根鍍有氯化銀的銀絲,構成氯化銀電極,為內參比電極。氯化銀電極的電極反應為:
![]()
電極電位的能斯特方程式為:
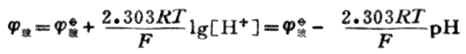
將氯化銀電極的銀絲與導線相連即構成玻璃電極。玻璃電極可表示為:
Ag,AgCl(s)│HCl(mol.L-1)│玻璃膜│待測溶液(H+)
因為玻璃電極內充液中CL-濃度為一常數,故內參比電極的電極電位值也為常數。
玻璃電極在使用前應先在蒸餾水中浸泡12-24h,使玻璃膜外側矽酸鹽層吸水膨潤形成一層水化凝膠層。玻璃膜內側浸泡在鹽酸中,也形成一層水化凝膠層。
當將浸泡過的玻璃電極插入具有一定PH值的待測溶液中時,在玻璃膜外側溶液中氫離子與膜外水化凝膠層中鈉離子進行交換。玻璃膜內側參比溶液中的氫離子與膜內水化凝膠層中鈉離子進行交換。當膜兩側H+濃度不同,離子交換達到平衡時,由於離子交換速度和擴散速度不同而出現了電位差。這種電位差稱為膜電位。由於膜內參比溶液的氫離子濃度為定值,所以膜電位僅由膜外溶液的氫離子濃度決定。膜電位值與H+濃度的關係符合能斯特方程。
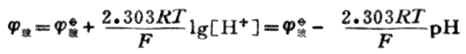
式中![]()
玻值與內參比電極的電極電位、膜內溶液的H+濃度以及膜表面狀態有關。在一定條件下,每一個玻璃電極的![]()
玻為常數.
(三)電位法測定溶液的PH值
電位法測 定溶液的PH值常用飽和甘汞電極作參比電極,玻璃電極作指示電極,置於待測溶液中組成如下電池。
Ag│AgCl(s),Cl-(0.1mol.L-1),H+(0.1mol.L-1)│玻璃膜│待測pH溶液 ‖KCL(飽和),Hg2Cl2(s)│Hg(1
測出的電動勢為飽和甘汞電極和玻璃電極的電位差值,即
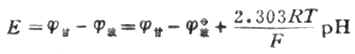
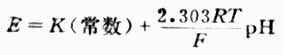
上式為溶液PH值與電池電動勢的關係式。測出E值值後,若是不知道常數K的數值,還是不能算出PH值。因此要先用已知PH值為PHs的標準緩衝溶液進行測測定,測出電動勢為Es,則可得關係式為:
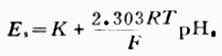 (6-6)
(6-6)
求出K值,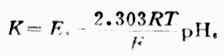
將電池裝置中的標準緩衝溶液換成待測pHx的溶液,測出電動勢為Ex,則
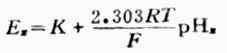 (6-7)
(6-7)
將式(6-7)代入式(6-8)得:
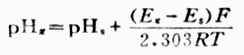 (6-9)
(6-9)
式中PHs 為已知數、Ex和 Es為先後兩次測出的電動勢,F,R,T為常數,故可根據式(6-9)計算出待測溶液的PH值。
| 關於「醫用化學/電極電位的應用」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |