醫用化學/電極電位
| 醫學電子書 >> 《醫用化學》 >> 氧化還原與電極電位 >> 電極電位 |
| 醫用化學 |
|
|
目錄 |
一、原電池
將鋅片插入CuSO4溶液中,鋅片上的Zn原子失去電子成為Zn2+而溶解;溶液中的Cu2+得到電子成為金屬Cu在鋅片上析出,即發生如下的氧化還原反應:
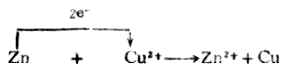
反應中電子從鋅原子轉移給銅離子。由於鋅片和硫酸銅溶液直接接觸,溶液中銅離子無秩序地自由運動,使得
Zn和Cu2+之間電子的轉移是直接的、無序的,不能定向地形成電流,化學能都以熱的形式散失在環境之中。
如果我們採用一個裝置(圖6-1),使鋅原子上的電子不直接轉移給銅離子,而是使還原劑Zn失去的電子沿著一條金屬導線轉移到氧化劑Cu2+上。這樣,在導線中就有電流通過。
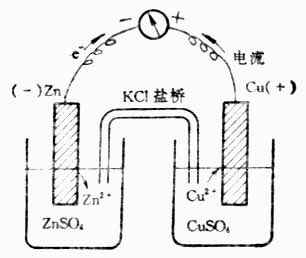
圖6-1 銅鋅原電池
這個裝置是在盛有ZnSO4與CuSO4溶液的燒杯中分別插入鋅片和銅片。兩個溶液用鹽橋相連。鹽橋是一支U形管,通常充滿用KCL(或KNO3)飽和了的瓊脂膠凍。用導線聯接兩個金屬片,並在導線中串聯一個靈敏的電流計。通過實驗可以看到:
電流計指針發生偏轉,說明金屬導線上有電流通過。根據指針偏轉的方向,可以確定鋅片為負極,銅片為正極。
鋅片開始溶解,而銅片上有金屬銅沉積上去。
取出鹽橋,電流計指針回到零點,放入鹽橋,電流計指針又偏轉。
對上述實驗現象可作如下分析:
鋅片溶解說明鋅片失去電子,成為Zn2+進入溶液。
Zn→Zn2++2e-
電子由鋅片經金屬導線流向銅片,溶液中Cu2+從銅片上得到電子成為銅原子在銅片上析出。
Cu2++2e-→Cu
鹽橋的溝通電路,使反應順利進行。因為隨著反應的不斷進行,在ZnSO4溶液中,Zn2+增多,溶液帶正電荷;在CuSO4溶液中,由於Cu2+變為Cu,Cu2+減少,溶液帶負電荷。這樣將阻礙Zn的繼續氧化和Cu2+的繼續還原。由於鹽橋的存在,其中CL-向ZnSO4溶液擴散,K+則向CuSO4溶液擴散,分別中和過剩的電荷,使兩溶液維持電中性,保證了氧化還原反應持續進行。
上述裝置中進行的總反應為,
Zn+Cu2+→Zn2++Cu
這一氧化不原反應分兩處進行,一處進行氧化,另一處進行還原。即電子不是直接從還原劑轉移到氧化劑,而是通過外電路進行傳遞,電子進行有規則的流動,從而產生電流,實現了由化學能到電能的轉變。這種藉助於氧化還原反應將化學能轉變為電能的裝置稱為原電池。上述由銅、鋅及其對應離子所組成的原電池叫做銅鋅原電池。
原電池由兩個半電池組成。在鯛銅鋅原電池中,鋅和鋅鹽溶液組成一個半電池,銅和銅鹽溶液組成另一個半電池。半電池又叫電極。
在原電池中,給出電子的電極為負極,發生氧化反應;接受電子的電極為正極,發生還原反應。在銅鋅原電池中,鋅半電池為負極,銅半電池為正極。
在負極或正極上進行的氧化或還原半反應叫做電極反應。總反應稱為電池反應。銅鋅原電池的電極反應和電池反應可分別表示如下:
電極反應負極 Zn→Zn2++2e-
正極 Cu2++2e-→Cu
電池反應Zn+Cu2+→Zn2++Cu
單獨表示電極組成時,作為導體的金屬通常寫在右邊。銅鋅原電池有兩個電極組成式為Zn2+│Zn和Cu2+│Cu。
為了方便,原電池裝置可用符號表示。書寫電池的慣例如下:
1.一般將負極寫在左邊,正極寫在右邊。
2.寫出電極的化學組成及物態,氣態要註明壓力(單位為kPa),溶液要註明濃度。
3.單線 「│ 」 表示極板與電極其餘部分的界面。
4.同一相中不同物質之間以及電極中其它相界面均用逗呈「,」分開。
5.雙線「‖」表示鹽橋。
6.氣體或液體不能直接作為電極,必須附以不活潑金屬(如鉑)作電極板起導體作用。純氣體、液體如H2(g)Br2(l)緊靠電極板。
銅鋅原電池的電池表示式為:
(一)Zn│Zn2+(c1)‖Cu+(c1)│Cu(+)
FeCL3和SnCL2溶液間可發生下面反應:
2FeCl3+SnCl2→2FeCl2+SnCl4
該反應可以組成一個原電池。電極反應和電池反應及電池表示式為:
電極反應 負極Sn2+→Sn4++2e-
正極Fe3++e→Fe2+
電池反應 2Fe3++Sn2+→2Fe2++Sn4+
電池表示式(-)Pt│Sn2+(c1),Sn4+(c2)‖Fe3+(c3),Fe2+(c4)│Pt(+)
上述電池兩個電極組成式為Sn4+,Sn2+│Pt和Fe3+,Fe2+│Pt。
二、電極電位的產生
用導線將原電池的兩個電極聯接起來,其間有電流通過。這表明兩個電極之間存在電位差。下面簡單介紹金屬及其鹽溶液之間相界面上電位差是怎樣產生的。
金屬晶體是由金屬原子、金屬離子和自由電子組成的。當把金屬插入其鹽溶液中時,金屬表面的離子與溶液中極性水分子相互吸引而發生水化作用。這種水化作用可使金屬表面上部分金屬離子進入溶液而把電子留在金屬表面上,這是金屬溶解過程。金屬越活潑,溶液越稀,金屬溶解的傾向越大。另一方面,溶液中的金屬離子有可能碰撞金屬表面,從金屬表面上得到電子,還原為金屬原子沉積在金屬表面上。這個過程為金屬離子的沉積。金屬越不活潑,溶液濃度越大,金屬離子沉積的傾向越大。當金屬的溶解速度和金屬離子的沉積速度相等時,達到了動態平衡。
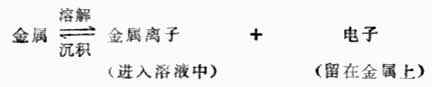
在一給定濃度的溶液中,若金屬失去電子的溶解速度大於金屬離子得到 電子的沉積速度,達到平衡時,金屬帶負電,溶液帶正電。溶液中的金屬離子並不是均勻分布的,由於靜電吸引,較多地集中在金屬表面附近的液層中。這樣在金屬和溶液的界面上形成了雙電層(圖6-2(a)),產生電位差。反之,如果金屬離子的沉積速度大於金屬的溶解速度,達到平衡時,金屬帶正電,溶液帶負電。金屬和溶液的界面上也形成雙電層(圖6-2(b)),產生電位差。金屬與其鹽溶液界面上的電位差稱為金屬的電極電位,常用符號![]()
表示。
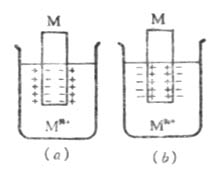
圖6-2 雙電層
金屬與溶液間電位差的大小,取決於金屬的性質,溶液中離子的嘗試和溫度。金屬越活潑,電位越低;越不活潑,電位越高。在同一種金屬電極中,金屬離子濃度越大,電位越高,濃度越小,電位越低。溫度越高,電位越高,溫度越低,電位越低。
三、電極電位的測定
(一)標準氫電極
電極電位的絕對值是無法測定的,但可以選定一個電極作為標準,將各種待測電極與它相比較,就可得到各種電極的電極電位相對值。國際純粹和應用化學協會(IUPAC)選定「標準氫電極」作為比較標準。
標準氫電極是氫離子濃度為1mol.L-1氫氣的壓力為101.325kPa的電極。國際上規定,298K 時,標準氫電極的電極電位為零。用符號![]()
H+/H2=0表示。其電極書寫為:
H+(1mol.L-1),H2(101.325kPa)│Pt
標準氫電極的裝置如圖6-3所示。容器中裝有H+濃度為1mol.L-1的硫酸溶液,插入一鉑片。為了增大吸附氫氣的能力,鉑片表面上鍍一層疏鬆的鉑(鉑黑0。在298k 時,不斷從套管的支管中通入壓力為101.325 kPa的純氫氣,H2被鉑黑吸附直到飽和.這時整個鉑黑片彷彿是由氫氣組成,鉑黑吸咐的H2和溶液中的H+構成了氫電極,其電極反應為;
![]()
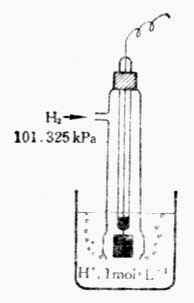
圖6-3 標準氫氣電極
(二)標準電極電位的測定
參與電極反應的各有關物質均為標準狀態(離子濃度為1mol.L-1,氣體物質的分壓為101.325 kPa)時,其電極電位稱為該 電極的標準電極電位,用符號![]() 表示。欲測定某標準電極的電位,可將該電極與標準氫電極組成原電池,書寫時把標準氫電極列於左側(假定為負極),將待測電極列於右側(假定為正極)。用電位計測定該原電池的標準電動勢 Eφ,則有
表示。欲測定某標準電極的電位,可將該電極與標準氫電極組成原電池,書寫時把標準氫電極列於左側(假定為負極),將待測電極列於右側(假定為正極)。用電位計測定該原電池的標準電動勢 Eφ,則有
Eφ=![]()
右-![]()
左=![]()
侍測-![]()
H+/H2
例2測定Zn 2+│Zn電極的標準電位,![]()
Zn2+/Zn。
解:將標準Zn2+│Zn電極與標準氫電極組成原電池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Zn2+(1mol.L-1)│Zn
298K時,測得Eφ=-0.7628(V)。
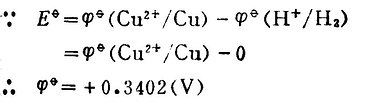
因為Zn 2+│Zn電極的電位為負值,低於標準氫電極的電位。所以Zn 2+│Zn是極為負極,標準氫電極為正極。其電極反應和電池反應為:
電極反應 負極Zn→Zn 2++2e-
正極2H++2e-→H2
電池反應 Zn+2H+→Zn 2++H2
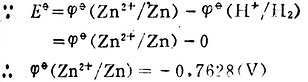
例3 測定Cu2+│Cu電極的標準電極電位,![]()
Cu2+/Cu。
解:將標準Cu2+│Cu電極與標準氫電極組成原電池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Cu2+(1mol.L-1)│Cu
298K時,測得Eφ=+0.3402(V)。
因為Cu2+│Cu電極的電位為正值,高於標準氫電極的電位。所以Cu2+│Cu電極,標準氫電極為負極。其電極反應和電池反應為,
電極反應 負極H2→2H++2e-
正極Cu2++2e-→Cu
電池反應 H2+Cu2+→2H++Cu
(三)標準電極電位表
用上述方法不僅可以測定金屬的標準電極電位,也可測定非金屬離子和氣體的標準電極電位。對於某些與水劇烈反應而不能直接測定的電極,可以通過熱力學數據用間接的方法計算出標準電極電位。表6-1列出了298k 時,一些物質在水溶液中的標準電極電位。
為了正確使用標準電極電位表,將有關問題概述如下:
1.在電極反應式氧化型 ![]()
還原型中,ne表示電極反應的電子數。氧
化型和還原型包括電極反應所需的H+,OH-,H2O等物質,如
![]()
氧化型與還原型是相互依存的。同一種物質在某一電對中是氧化型,在另一電對中也可以是還原型。例如,
![]()
中是氧化型,在
![]()
( ![]() =0.77V)
=0.77V)
中是還原型。所以在討論與Fe2+有關的氧化還原反應時,若Fe2+是作為還原劑而被氧化為Fe3+,則必須用與還原型的Fe2+相對應的電對的 ![]()
值(0.77V)。反之,若Fe2+是作為氧化劑而被還原為Fe,則必須用與氧化型的Fe2+相對應的電對的![]()
值(-0.88V)。
2.表6-1採用的電位是還原電位。不論電極進行氧化或還原反應,電極電位符號不改變。例如,不管電極反應是Zn→Zn2++2e-還是Zn2++2e-→Zn,Zn2+ │Zn電極標準電極電位值均取-0.7628V。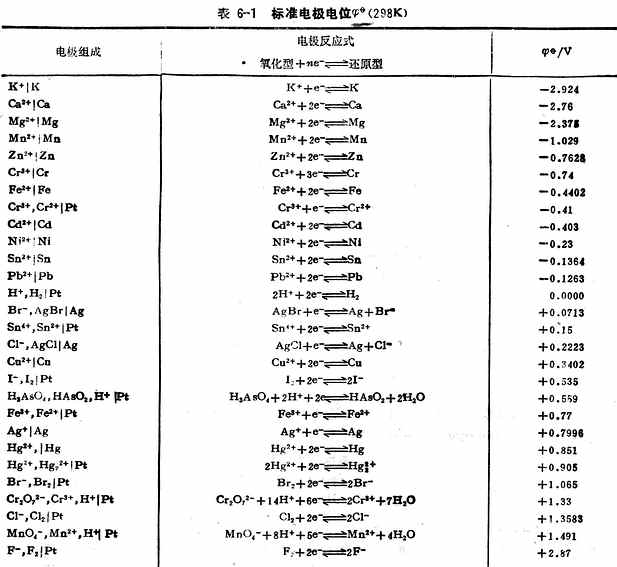
![]()
愈高,表示該電對的氧化型愈容易接受電子,氧化其它物質的能力愈強,它本身易被還原,是一個強氧化劑,而它的還原能力愈弱;![]()
愈低,表示該電對的還原型愈容易放出電子,還原其它物質的能力愈強,它本身易被氧化,是一個強還原劑,而它的氧化型的氧化能力愈弱。
電極反應式左方的氧化型可作氧化劑,右方的還原型可作還原劑。氧化型在表的愈下方就是愈強的氧化劑;還原型在表的愈上方就是愈強的還原劑。因此,在不同的氧化劑或在不同的還原劑之間進行強弱比較時,根據標準電極電位的數值可以明確地判斷它們的強弱。例如,在表上所列的各物質中,F2是最強的氧化劑,k 是最強的還原劑。
4.標準電極電位![]()
值與電極反應中物質的計量係數無關。例如,Ag+│Ag電極的電極反應寫成,若寫成。?![]()
(Ag+/Ag)仍是+0.7996V,而不是2*0.7996V.
5.電極電位和標準電極電位,都是電極處於平衡狀態時表現時出來的特徵,它和達到平衡的快慢無關。
根據上面所述,在標準狀態下,由任何兩個電極(半電極)組成電池時,電極電位較高的一方,由於有較強的氧化劑,起還原作用為正極;電極電位較低的一方,由於有較強的還原劑,起氧化作用為負極。
四、影響電極電位的因素
(一)能斯特(Nernst)方程式
一個電極的電極電位的大小與溫度、濃度間的關係可用能斯特方程式表示:
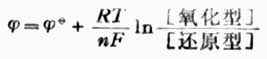 (6-2)
(6-2)
式中![]()
——電極電位,單位為V
![]()
——標準電極電位,單位為V
R-—氣體常數,8.314J-1.Kmol-1
F——法拉弟常數,96490C.mol-1
T——絕對溫度,K
n——電極反應得失的電子數
當溫度為298K時,將各常數值代入式(6-2),並將自然對數轉換成常用對數,能斯特方程式可改寫為:
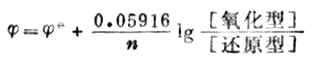 (6-3)
(6-3)
應用能斯特方程式時,應注意以下幾點:
1.若電極反應式中有純固體、純液體或介質水時,它們的濃度不列入方程式中;氣體物質用分壓,即101.325kPa的倍數表示。
2.若電極反應式中氧化型、還原型物質前的係數不等於1時,則在方程式中它們的濃度項應以對應的係數為指數。
3. 氧化型、還原型物質包括與它們同存在的有關物質。例如, ,[氧化型]=[MnO4-][H+]8。
(二)有關能斯特方程式的計算
1.計算電極電位
利用能斯特方程式,可以計算不同條件下的電極電位值。
例4 計算298K,鋅離子濃度為0.01mol.L-1時,Zn2+│Zn電極的電極電位。
解:電極反應
![]()
已知n=2,[Zn2+]=0.01mol.L-1, ![]()
(Zn2+/Zn)=-0.7628V,則,
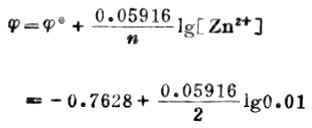
=-0.7628-0.05916
=-0.822(V)
在此例中,由於[Zn2+]<1mol.L-1,所以 ![]()
![]()
。若金屬離子濃度愈小,則金屬的電極電位愈低表明還原劑失電子的傾向增強了。
例5 計算298K時,Pt│Fe3+(mol.L-1),Fe2+(0.001mol.L-1)電極的電極電位。
解: 電極反應:
![]()
已知n=1,[Fe3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,![]()
(Fe3+/Fe2+)=0.77V,則
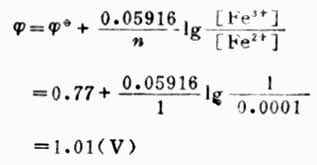
從本例中可以看出,氧化型離子濃度愈大,或還原型離子愈小,電極電位愈高,表明氧化型得電子的傾向愈大。也就是說電極電位隨著氧化型物質濃度增大而升高,隨著還原型物質濃度增大而降低。
例6 求電極反應
![]()
在pH=5溶液中的電極電位(其他條件同標準狀態)。
解:已知n=5,[MnO4+-]=[Mn2+]=1mol.L-1,[H+]=10-5mol.L-1,![]()
(MnO4-/Mn2+)=+1.491V,則
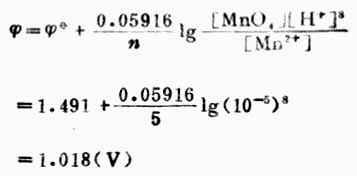
計算結果表明,[H+]降低,對應的氧化型物質(MnO4-)的氧化能力降低。
2.判斷原電池的正、負極,計算電動勢
通常組成原電池的各有關物質並不是處於標準狀態。計算原電池的電動勢,首先根據標準電極電位表,利用能斯特方程計算出標準狀態下各電極的電極電位。然後根據電極電位的高低判斷正、負極,把電極電位高的電極作正極,電極電位低的電極作負極。正極的電極電位減去負極的電極電位即得原電池的電動勢。
例7 計算298K時,電池Cu│Cu2+(0.1mol.L-1)‖Fe2+(0.1mol.L-1);Pt的電動勢,並說明它是否按慣例書寫正負極,列出電池反應式。
解:從表6-1中查出電極反應式及標準電極電位:
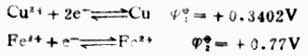
根據能斯特方程式,分別計算它們在非標準狀態下的電極電位。

計算結果表明,電池右側是正極,左側是負極。該原電池是按慣例書寫的。原電池的電動勢為:
E= ![]()
右-![]()
左=0.83-0.31=0.52(V)
電極反應 負極 Cu→Cu2++2e-(氧化反應)
正極 Fe3++e- →Fe2+(還原反應)
電池反應 Cu+2Fe3+→Cu2++2Fe2+
例8 計算298K時,電池Pt│I2,I-(0.1mol.L-1)‖MnO4-(0.1mol.L-1),Mn2+(0.1mol.L-1),H+(0.01mol.L-1)│Pt的電動勢並寫出電池反應式。
解:由表6-1中查出電極反應式及標準電極電位:
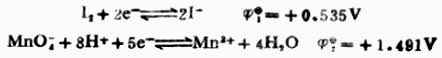
根據能斯特方程式,分別計算非標準狀態下的電極電位。

計算表明,電池右側電極的電極電位高為正極,左側電極電位低為負極。所以,
E= ![]()
右-![]()
左=1.195-0.594
=0.601(V)
電極反應 2I-→I2+2e- (氧化反應)
正極MnO-4+8H++5e-→Mn2++4H2o (還原反應)
電池反應 2MnO-4+10I-+16H+ →2Mn2++5I2+8H2O
| 關於「醫用化學/電極電位」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |