醫用化學/溶液的滲透壓
| 醫學電子書 >> 《醫用化學》 >> 溶液 >> 溶液的滲透壓 |
| 醫用化學 |
|
|
滲透作用是自然界的一種普遍現象,它對於人體保持正常的生理功能有著十分重要的意義。下面討論滲透作用的基本原理、滲透壓及其在醫學上的意義。
一、滲透現象和滲透壓
在蔗糖濃溶液上小心加入一層清水,水分子即從上層滲入下層,蔗糖分子也由下層湧入上層,直到蔗糖溶液的濃度均勻為止。一種物質的粒子自發地分布於另一種物質中的現象稱為擴散。
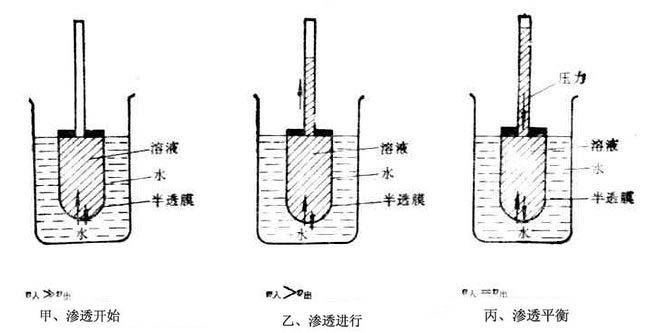
如果將蔗糖水溶液與水用半透膜隔開(圖1-2甲),使膜內和膜外液面相平,靜置一段時間後,可以看到膜內溶液的液面不斷上升(圖1-2乙),說明水分子不斷地透過半透膜進入溶液中。溶劑透過半透膜進入溶液的自發過程稱為滲透現象。不同濃度的兩種溶液被半透膜隔開時都有滲透現象發生。
半透膜是一種只允許某些物質透過,而不允許另一些物質透過的薄膜。上面實驗中的半透膜只允許水分子透過,而蔗糖分子卻不能透過。細胞膜、膀胱膜、毛細血管壁等生物膜都具有半透膜的性質。人工製造的火棉膠膜、玻璃紙等也具有半透膜的性質。
上述滲透現象產生的原因是蔗糖分子不能透過半透膜,而水分子卻可以自由通過半透膜。由於膜兩側單位體積內水分子數目不等,水分子在單位時間內從純水(或稀溶液)進入蔗糖溶液的數目,要比蔗糖溶液中水分子在同一時間內進入純水(或稀溶液)的數目多,因而產生了滲透現象。滲透現象的產生必須具備兩個條件:一是有半透膜存在,二是半透膜兩側必須是兩種不同濃度的溶液。
圖1-2是滲透過程的示意圖,圖中v入表示水分子進入半透膜內的速度,v出表示膜內水分子透出到膜外的速度。甲表示滲透剛開始,乙表示滲透不斷進行,管內液面不斷上升。但是液面的上升不是無止境的,而是達到某一高度時便不再上升(圖1-2丙),此時,v入=v出,滲透達到平衡狀態即滲透平衡。阻止純溶劑向溶液中滲透,在溶液液面上所施加的壓力為該溶液的滲透壓。
如果被半透膜隔開的是兩種不同濃度的溶液,這時液柱產生的靜液壓,既不是濃溶液的滲透壓,也不是稀溶液的滲透壓,而是這兩種溶液滲透壓之差。
滲透壓的單位用Pa或kPa表示。
滲透壓是溶液的一個重要性質,凡是溶液都有滲透壓。滲透壓的大小與溶液的濃度和溫度有關。
二、滲透壓與濃度、溫度的關係
1886年范特荷甫(van』t Hoff)根據實驗數據得出一條規律:對稀溶液來說,滲透壓與溶液的濃度和溫度成正比,它的比例常數就是氣體狀態方程式中的常數R。這條規律稱為范特荷甫定律。用方程式表示如下:
πV=nRT
或π=cRT(1-5)
式中π為稀溶液的滲透壓,V為溶液的體積,c為溶液的濃度,R為氣體常數,n為溶質的物質的量,T為絕對溫度。
式(1-5)稱為范特荷甫公式,也叫滲透壓公式。常數R的數值與π和V的單位有關,當π的單位為kPa,V的單位為升(L)時,R值為8.31kPa•L•K-1•mol-1。
范特荷甫公式表示,在一定溫度下,溶液的滲透壓與單位體積溶液中所含溶質的粒子數(分子數或離子數)成正比,而與溶質的本性無關。
對於稀溶液,c近似於質量摩爾濃度,因此上式又可寫成
π=mBRT
對於相同cB的非電解質溶液,在一定溫度下,因為單位體積溶液中所含溶質的粒子(分子)數目相等,所以滲透壓是相同的。如0.3mol•L-1葡萄糖溶液與0.3mol•L-1蔗糖溶液的滲透壓相同。但是,相同cB的電解質溶液和非電解質溶液的滲透壓則不相同。例如,0.3mol.L-1NaCl溶液的滲透壓約為0.3mol.L-1葡萄糖溶液滲透壓的2倍。這是由於在NaCl溶液中,每個NaCl粒子可以離解成1個Na+和1個Cl-。而葡萄糖溶液是非電解質溶液,所以0.3mol•L-1NaCl溶液的滲透壓約為0.3 mol•L-1葡萄糖溶液的2倍。
由此可見,滲透壓公式中,對電解質溶液來說,濃度cB(或mB)是1升溶液中能產生滲透效應的溶質分子與離子總物質的量,稱為滲透物質的量濃度。
通過測定溶液的滲透壓,可以計算溶質的相對分子質量。如果溶質的質量為m,摩爾質量為M。實驗測得溶液的滲透壓為π,則該溶質的相對分子質量(數值等於摩爾質量)可通過下式求得:
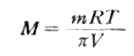 (1-6)
(1-6)
式(1-6)主要用於測定高分子(蛋白質等)的相對分子質量。
滲透壓公式在醫療工作中有其現實意義。人體血液的滲透壓在正常體溫(37℃)時約為769.9kPa。要配製與血液滲透壓相等的溶液,即可由滲透壓公式計算出溶液的濃度。
三、滲透壓在醫學上的意義
(一)等滲、低滲、高滲溶液
滲透壓相等的兩種溶液稱為等滲溶液。滲透壓不同的兩種溶液,把滲透壓相對高的溶液叫做高滲溶液,把滲透壓相對低的溶液叫做低滲溶液。對同一類型的溶質來說,濃溶液的滲透壓比較大,稀溶液的滲透壓比較小。因此,在發生滲透作用時,水會從低滲溶液(即稀溶液)進入高滲溶液(即濃溶液),直至兩溶液的滲透壓達到衡為止。
在醫療實踐中,溶液的等滲、低滲或高滲是以血漿總滲透壓為標準。即溶液的滲透壓與血漿總滲透壓相等的溶液為等滲溶液。溶液的滲透壓低於血漿總滲透壓的溶液為低滲溶液。溶液的滲透壓高於血漿總滲透壓的溶液為高滲溶液。
給傷病員進行大量補液時,常用與血漿等滲的0.154mol•L-1NaCl溶液(生理鹽水),而不能用0.256 mol•L-1NaCl的高滲溶液或0.068 mol•L-1NaCl的低滲溶液。這是與血漿滲透壓有關的問題。下面討論紅細胞分別在這三種NaCl溶液中所產生的現象。
將紅細胞放到0.068 mol•L-1 NaCl溶液中,在顯微鏡下可以看到紅細胞逐漸膨脹,最後破裂。醫學上稱這種現象為溶血。這是因為紅細胞內液的滲透壓大於0.068mol.L-1NaCL溶液滲透壓,因此,水分子就要向紅細胞內滲透,使紅細胞膨脹,以致破裂.如將紅細胞放到0.256mol.L-1NaCL溶液中,在顯微鏡下可以看到紅細胞逐漸皺縮,這種現象稱為胞漿分離.因為這時紅細胞內液的滲透壓小於0.256mol.L-1NaCL溶液的滲透壓,因此,水分子由紅細胞內向外滲透,使紅細胞皺縮.如將紅細胞放到生理鹽水中,在顯微鏡下看到紅細胞維持原狀.這是因為紅細胞與生理鹽水滲透壓相等,細胞內外達到滲透平衡的緣故.圖1-3為細細胞在不同濃度NaCL溶液中的形態圖。
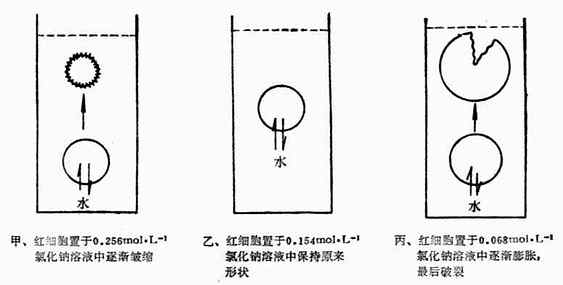
圖1-3 紅細胞在不同濃度NaCl溶液中的形態未意圖
在醫療工作中,不僅大量補液時要注意溶液的滲透壓,就是小劑量注射時,也要考慮注射液的滲透壓。但臨床上也有用高滲溶液的,如滲透壓比血漿高10倍的2.78mol.L-1葡萄糖溶液。因對急需增加血液中葡萄糖的患者,如用等滲溶液,注射液體積太大,所需注射時間太長,反而不易收效。需要注意,用高滲溶液作靜脈注射時,用量不能太大,注射速度不可太快,否則易造成局部高滲引起紅細胞皺縮。當高滲溶液緩緩注入體內時,可被大量體液稀釋成等滲溶液。對於劑量較小濃度較稀的溶液,大多是將劑量較小的藥物溶於水中,並添加氯化鈉、葡萄糖等調製成等溶液,亦可直接將藥物溶於生理鹽水或0.278mol.L-1葡萄糖溶液中使用,以免引起紅細胞破裂。
(二)毫滲透量濃度
人的體液中既有非電解質(如葡萄糖等),也有電解質(如NaCL,CaCL2,NaHCO3等鹽類)。為了表示體液總的滲透壓大小,醫學上常用毫滲透量濃度來比較,簡稱毫滲量.升-1,用mOsm.L-1表示。這種濃度是溶液中能產生滲透作用的溶質的粒子(分子或離子)的總物質的量濃度。
例7分別計算0.278mol.L-1葡萄糖溶液和生理鹽水(0.154mol.L-1NaCL)的毫滲透量濃度。
解:0.278mol.L-1葡萄糖溶液的毫滲透量濃度為:0.278×1000=278≈280(mOsm.L-1)生理鹽水的毫滲透量濃度為:0.154×2×1000=308(mOsm.L-1)
由於在一定溫度下,溶液的滲透壓與溶液的毫滲量.升-1成正比,因此,常用它來衡量或比較溶液滲透壓的大小.表1-4為正常人血漿中各種離子的毫滲量濃度.
從表4-1可看出,正常人血漿中各種離子的總濃度為151.0+139.5=290.5mOsm.L-1(血漿中非電解質如葡萄糖、尿素等含量較少,僅相當於5mOsm.L-1左右)。臨床上規定血漿總滲量濃度正常範圍是280~320mOsm.L-1。如果溶液的毫滲透量濃度處於這個範圍以內,則為血漿的等滲溶液;小於此範圍的溶液為低滲溶液;大於此範圍的溶液則為高滲溶液。
表1-4 正常人血漿中各種離子的mOsm.L-1
| 正離子 | mOsm.L-1 | 負離子 | mOsm.L-1 |
| Na+ | 142 | CL- | 103 |
| K+ | 5 | HCO3- | 27 |
| Ca+ | 2.5 | HPO42- | 1 |
| Mg2+ | 1.5 | SO42- | 0.5 |
| 有機酸 | 6 | ||
| 蛋白質 | 2 | ||
| 總量 | 151.0 | 總量 | 139.5 |
由例7計算結果說明生理鹽水為血漿的等滲溶液,0.278mol.L-1葡萄糖溶液為278mOsm.L-1近似於280mOsm.L-1,所以它也是血漿的等滲溶液.
臨床上常用的等滲溶液有:
1. 生理鹽水(0.154mol.L-1NaCL溶液),毫滲透量深度為308mOsm.L-1。
2.0.278mol.L-1葡萄糖溶液,亳滲量溶液濃度為278mOsm.L-1(近似於280mOsm.L-1)。
3.0.149mol.L-1碳酸氫鈉溶液,毫滲透量濃度為298mOsm.L-1。
臨床上常用的高滲溶液有:
1.0.513mol.L-1.NaCL溶液,毫滲透量濃度為1026mOsm.L-1.
2.0.278mol.L-1葡萄糖氯化鈉溶液(是生理鹽水中含0.278mol.L-1葡萄糖),毫滲透量濃度應為308+278=586mOsm.L-1,其中生理鹽水維持滲透壓,葡萄糖則供給熱量和水.
3.2.78mol.L-1葡萄糖溶液,毫滲透量濃度為2780mOsm.L-1。
血漿中含有低分子的晶體物質(如氯化鈉、葡萄糖和碳酸氫鈉等)和高分子的膠體物質(如蛋白質)。血漿中的滲透壓是這兩類物質所產生滲透壓的總和。其中由低分子晶體物質產生的滲透壓叫做晶體滲透壓;由高分子膠體物質產生的滲透壓叫做膠體滲透壓。
血漿中低分子晶體物質的含量約為0.7%,高分子膠體物質的含量約為7%.雖然高分子膠體物質的百分含量高,它們的相對分子質量卻很大,因此,它們的粒子數很少.低分子晶體物質在血漿中含量雖然很低,但由於相對分子質量很小,多數又可離解成離子,因此粒子數較多.所以,血漿總滲透壓絕大部分是由低分子的晶體物質產生的.在37℃時,血漿總滲透壓約為769.9kPa,其中膠體滲透壓僅為2.9~4.0kPa.
人體內半透膜的通透性不同,晶體滲透壓和膠體滲透壓在維持體內水鹽平衡功能上也不相同。膠體滲透壓雖然很小,但在體內起著重要的調節作用。
細胞膜是體內的一種半透膜,它將細胞內和細胞外液隔開,並只讓水分子自由透過膜內外,而K+、Na+則不易自由通過。因此,水在細胞內外的流通,就要受到鹽所產生的晶體滲透壓的影響。晶體滲透壓對維持細胞內外水分的相對平衡起著重要作用。臨床上常用晶體物質的溶液來糾正某些疾病所引起的水鹽失調。例如,人體由於某種原因而缺水時,細胞外液中鹽的濃度將相對升高,晶體滲透壓增大,於是使細胞內液的水分通過細胞膜向細胞外液滲透,造成細胞內液失水。如果大量飲水或者輸入過多的葡萄糖溶液,則使細胞外液鹽濃度降低,晶體滲透壓減小,細胞外液中的水分向細胞內液中滲透,嚴重時可產生水中毒。高溫作業之所以飲用鹽汽水,就是為了保持細胞外液晶體滲透壓的恆定。
毛細血管壁也是體內的一種半透膜,它與細胞膜不同,它間隔著血漿和組織間液,可以讓低分子如水、葡萄糖、尿素、氫基酸及各種離子自由透過,而不允許高分子蛋白質通過。所以,晶體滲透壓對維持血液與組織間液之間的水鹽平衡不起作用。如果由於某種原因造成血漿中蛋白質減少時,血漿的膠體滲透壓就會降低,血漿中的水就通過毛細血管壁進入組織間液,致使血容量降低而組織液增多,這是形成水腫的原因之一。臨床上對大面積燒傷,或者由於失血而造成血容量降低的患者進行補液時,除補以生理鹽水外,同時還需要輸入血漿或右旋糖酐等代血漿,以恢復血漿的膠體滲透壓和增加血容量。
| 關於「醫用化學/溶液的滲透壓」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |