醫用化學/溶解度
| 醫學電子書 >> 《醫用化學》 >> 溶液 >> 溶解度 |
| 醫用化學 |
|
|
在一定條件(溫度、壓力)下,一定量的溶劑溶解溶質達飽和時,所含溶質的量稱為溶解度。任何一種表示濃度的單位都可用來作為溶解度的單位。因此,根據工作需要,溶解度可以有各種不同的表示法,通常用一定溫度下,100克溶劑形成飽和溶液時所溶解溶質的質量(單位為克)表示。
物質溶解度的大小與很多因素有關,主要決定於溶質和溶劑的本性以及外界的溫度和壓力。
一、 固體在液體中的溶解度
溫度對固體物質溶解度的影響,可以通過實驗繪成的溶解度曲線來表示。圖1-1是幾種固體鹽類在水中的溶解度曲線。
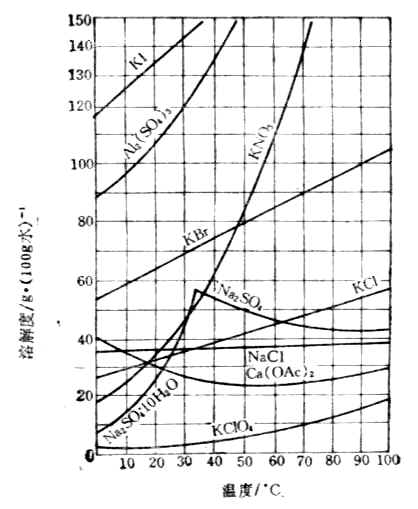
圖1-1 溶解度曲線
從圖1-1中可以看出,大多數固體物質的溶解度隨溫度升高而增大。個別物質如醋酸鈣的溶解度,隨溫度的升高反而減小。還可看到硫酸鈉的溶解度曲線,在32.4℃時出現了一個轉折點。這是因為32.4℃左右時,硫酸鈉的存在形式不同。在32.4℃以下,與飽和溶液呈平衡的固體是含結晶水的硫酸鈉Na2SO4.10H2O,隨溫度升高溶解度增大。在32.4℃以上,與飽和溶液呈平衡的固體是無水硫酸鈉Na2SO4,隨溫度上升而溶解度減小。
利用在不同溫度下物質的溶解度不同這一性質,可以進行物質的提純以除去其中雜質。在實際工作中,常將要是純的物質先加熱溶解於適當的溶劑中,使其成為飽和或接近飽和溶液,趁熱濾去不溶性雜質,然後將溶液冷卻,這時因物質的溶解度減小,勢必從溶液中析出結晶,而可溶性雜質由於含量少,遠未達到飽和而留在母液中。最後過濾,使析出的結晶與母液分離而得到較純物質。這種操作稱為重結晶。
值得注意的是有些物質在溫度降低時,溶液中所含溶質的量雖超過了該溫度下飽和溶液所含溶質的量,溶質也不析出,這種溶液稱為過飽和溶液。過飽和溶液是不穩定的體系,稍一振蕩或投入一小顆粒結晶,多餘的溶質立即從溶液中析出而成為飽和溶液。
二、氣體在液體中的溶解度
氣體的溶解平衡是指在密閉容器中,溶解在液體中的氣體分子與液體上面的氣體分子保持平衡。溶解達平衡時,氣體在液體中的濃度就是氣體的溶解度。通常用1體積液體中所能溶解氣體的體積表示。表1-1是一些氣體在水中的溶解度。
表1-1 一些氣體在水中的溶解度
| 溫度/℃ | O2 | H2 | N2 | CO2 | HCL | NH3 |
| 0 | 0.0489 | 0.0215 | 0.0235 | 1.713 | 507 | 1176 |
| 20 | 0.0310 | 0.0182 | 0.0155 | 0.878 | 442 | 702 |
| 30 | 0.0261 | 0.0170 | 0.0134 | 0.665 | 413 | 586(28℃) |
| 35 | 0.0244 | 0.0167 | 0.0126 | 0.592 | —— | —— |
從表1-1中可以明顯地看出,溫度升高,氣體的溶解度減小。也可以看出,不同的氣體在水中的溶解度相差很大,這與氣體及溶劑的本性有關。H2,O2,N2等氣體在水中的溶解度較小,因為這些氣體在溶解過程中不與水發生化學反應,稱為物理溶解。而CO2,HCL,NH3等氣體在水中的溶解度較大,因為這些氣體在溶解過程中與水發生了化學反應,稱為化學溶解。
氣體在液體中的溶解,除與氣體的本性、溫度有關外,壓力對氣體的溶解度的影響也比較大。壓力和分壓的單位是帕(或帕斯卡,符號Pa),通常用千帕(符號kPa)表示。101.325kPa(或101325Pa)相當於過去1atm(1大氣壓),133.32Pa相當於1mmHg,作為非國際單位制的atm和mmHg本書不再使用。
(一)分壓定律
混合氣體的總壓力等於各組分氣體分壓力之和。這一定律稱為分壓定律。這種關係可用數學式表示。
p=p1+p2+p3+…
式中,p是混合氣體的總壓力,p1,p2,p3等是各組分氣體的分壓力。
混合氣體中每一種氣體的分壓力,可由總壓力和該氣體在混合氣體中所佔的體積百分數或摩爾分數的乘積來計算:
p1=p×(%V1)
或 p1=p×x1
式中,p為氣體總壓力,%V1為氣體1的體積百分數,x1為氣體1的摩爾分數。
例1 人的肺泡氣總壓力為101.325kPa,37℃時,它的組成用體積百分數表示分別為:O2為13.4%,CO2為5.3%,N2為75%,H2O(蒸汽)為6.3%,試求各氣體在肺泡中的分壓。
解:po2=101.325kPa×13.4%=13.6kPa
pCO2=101.325kPa×5.3%=5.4kPa
pN2=101.325kPa×75%=76.0kPa
pH2O=101.325kPa×6.3%=6.4kPa
(二)亨利定律
1803年亨利(Henry)從實驗中總結出一條規律,其內容是:「在一定溫度下,氣體溶解達到平衡時,氣體在液體中的溶解度和氣相中該氣體的分壓成正比。」這一規律稱為亨利定律。可用數學式表示:
c=Kp (1-1)
式中,c為氣體在液體中溶解度,一般是指1kg水中溶解氣體的質量(克);p為液面上氣體的平衡分壓;K為常數,是該氣-液體系的特徵常數。
必須注意,亨利定律只適用於壓力不大(一般為202.3~303.9kPa)和溶解度很小的氣體。溫度越高或壓力越低,在稀溶液中應用亨利定律能得到較準確的結果。另外,亨利定律只適用於不與溶劑發生化學反應的氣體,即溶質在氣相和液相中的分子狀態必須是相同的。
例2 在0℃,平衡壓力為303.9kPa。氧氣的溶解度為0.2085g/1000g水。求在同溫度、平衡壓力為202.6kPa下氧氣的溶解度。
解:由式(1-1)先求K值:
K=c/p=0.2085/303.9=0.000686(g/1000g水•kPa)
對於一定氣體和溶劑,在一定溫度下,K是一個常數,與氣體的壓力無關.在平衡壓力為202.6kPa時,將K值代入式(1-1),則得在水中溶解度為:
c=Kp=0.000686×202.6=0.139(g/1000g水)
亨利定律在醫學上有許多應用實例。例如,使用麻醉氣體時,氣體的分壓越大,則它在血液中的溶解度就越大。高壓氧氣艙的壓力為202.6-253.25kPa,比常壓為大,因此溶於病人血液的氧氣就越多.利用亨利定律還可以解釋人在呼吸過程中O2和CO2的交換等。
(三)氣體吸收係數
由於氣體的體積比質量容易測定,所以氣體的溶解度以溶解氣體的體積表示比較方便。為了表示各種氣體在不同溫度和分壓下的溶解度,規定將不同狀態下所溶解氣體的體積,均換算成標準狀況下的體積數。
氣體吸收係數(a)是指在一定溫度下,1體積的液體在該氣體分壓為101.3kPa下,所能溶解氣體的體積.氣體體積如果不是標準狀況(0℃,101.3kPa),一般要換算為標準狀況.如在20℃和氫氣分壓為101.3kPa下,1L水能溶解氫氣0.0195L.根據查理(Charles J.A.C.)定律可將其換算為標準狀況下的體積:
0.0195L×273K/(273+20)K=0.0182(L)
0.0182即是在20℃時,101.3kPa下,氫氣在水中的吸收係數。
與醫學有關的氣體在水和血漿中的吸收係數列於表1-2。
表1-2 37℃時氣體在水和血漿中的吸收係數
| 氣體 | 在水中的吸收係數 | 在血漿中的吸收係數 |
| O2 | 0.0239 | 0.0214 |
| CO2 | 0.567 | 0.515 |
| N2 | 0.0123 | 0.0118 |
從表1-2可以看出,當水中含有其他雜質時,氣體的溶解度減少,尤其是有鹽類存在時.由於鹽類離子與水分子形成水合離子,這時影響則更大.血漿中含有鹽類和蛋白質等,故氣體在血漿中的溶解度比在水中要小.
利用表1-2的吸收係數,根據肺泡中O2,CO2,N2的分壓,就能算出它們溶解在血漿中的體積百分數.
已知肺泡氣體中Po2=13.6kPa,Pco2=5.3kPa.PN2=76.0kPa.因此,100mL血漿中所溶解的三種氣體的體積百分數為:
O2%=0.0214×13.6/101.3×100=0.287(mL/100mL血漿)
CO2%=0.515×5.3/101.3×100=2.69(mL/100mL血漿)
N2%=0.0118×76/101.3×100=0.885(mL/100mL血漿)
三、液體在液體中的溶解度
一種液體在另一種液體中的溶解有三種情況:第一種是兩種液體完全互溶,如乙醇與水、甘油與水等。第二種是兩種液體部分互溶,如乙醚與水等。第三種是兩種液體完全不溶,如苯與水、四氯化碳與水等。
將兩種互不混溶的液體放在同一容器中,就會分成兩相,密度大的一相的在下層,密度小的一相在上層。在一定溫度下,一種溶質在相互接觸的兩種互不混溶的溶劑中,溶解達平衡時,溶質在兩相中的濃度比是一個常數,這一定律稱為分配定律。可表示如下式:
CA/CB=K (1-2)
式中CA、CB分別表示溶質在溶劑A、B中的濃度;常數K稱為分配係數,它與溶質和溶劑的本性、溫度及壓力有關。
例如,將水和四氯化碳放在一起,加入少量碘,碘微溶於水、溶於四氯化碳。
在這兩種液體中的溶解度差別很大。當溫度一定時,水中碘的濃度與四氯化碳中碘的濃度比是一個常數。表1-3是碘在四氯化碳和水中分配情況。
| CB(I2在CCl4中)/mol.L-1 | CA(I2在H2O中)/mol.L-1 | CA/CB=K |
| 0.02 | 0.00023 | 0.0115 |
| 0.04 | 0.00046 | 0.0115 |
| 0.06 | 0.000702 | 0.0117 |
| 0.08 | 0.000928 | 0.0116 |
根據分配定律的原理,利用同一溶質在互不混溶的兩種溶劑中溶解度的差別,可以選取適當溶劑,從另一溶液中將溶質提取出來。這個過程稱為萃取。
萃取是一種有效的提純、分離技術。為了充分使用一定量的萃取劑以提高萃取效率,採取每次少量,多次萃取的方法,要比一次用完萃取的效果好得多。反覆多次萃取,萃取就可接近完全。
| 關於「醫用化學/溶解度」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |