醫用化學/氫鍵
| 醫學電子書 >> 《醫用化學》 >> 原子結構和分子結構 >> 氫鍵 |
| 醫用化學 |
|
|
目錄 |
一、氫鍵的本質
氫原子與電負性很大、半徑很小的原子X(F,O,N)以共價鍵形成強極性鍵H-X,這個氫原子還可以吸引另一個鍵上具有孤對電子、電負性大、半徑小的原子Y,形成具有X-H…Y形式的物質。這時氫原子與y 原子之間的定向吸引力叫做氫鍵(以H…Y表示)。
氫鍵的本質一般認為主要是靜電作用。在X-H…Y中,X-H是強極性共價鍵,由於X的電負性很大,吸引電子能力強,使氫原子變成一個幾乎沒有電子云的「裸露」的質子而帶部分正電荷。它的半徑特別小,電場強度很大,又無內層電子,可以允許另一個帶有部分負電荷的Y原子(即電負性大,半徑小且有孤對電子的原子)充分接近它,從而產生強烈的靜電相互作用而形成氫鍵。
一般分子形成氫鍵必須具備兩個基本條件:
1.分子中必須有一個與電負性很強的元素形成強極性鍵的氫原子。
2.分子中必須有帶孤對電子,電負性大,原子半徑小的元素。
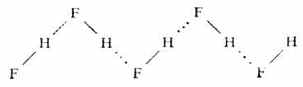
氫鍵常在同類分子或不同類分子之間形成,叫做分子間氫鍵,如氟化氫、氨水:
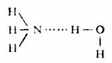
二、氫鍵的鍵長和鍵能
氫鍵的鍵長是指X-H…Y中X與Y原子的核間距離。在HF締合而成的(HF)n締合分子中,氫鍵的鍵長為255pm,而共價鍵(F-H間)鍵長為92pm。由此可得出,H…F間的距離為163pm(255-92)。可見氫原子與另一個HF分子中的F原子相距是較遠的。
氫鍵的鍵能是指被破壞H…Y鍵所需要的能量。氫鍵的鍵能約為15-30kJ.mol-1,比一般化學鍵的鍵能小得多,和范德華力的數量級相同。氫鍵的強弱與X和Y的電負性大小有關。電負性越大,氫鍵的強弱還和Y的半徑大小有關,y 的半徑越小,越能接近H-X鍵,形成的氫鍵也越強。例如F的電負性最大,半徑又小,所以F-H…F是最強的氫鍵,O-H…O次之,O-H…N又次之,N-H…N更次之。
三、氫鍵的飽和性和方向性
氫鍵具有飽和性和方向性。氫鍵的飽和性表現在X-H只能和一個Y原子相對合。因為H原子體積小,X、Y都比氫大,所以當有另一個Y原子接近他們時,這個Y原子受到X-H…Y上X和Y的排斥力大於受到H原子的吸引力,使得X-H…Y上的氫原子不能再和第二個Y原子結合,這就是氫鍵的飽和性。
氫鍵的方向性是指Y原子與X-H形成氫鍵時,在儘可能的範圍內要使氫鍵的方向與X-H鍵軸在同一個方向,即以H原子為中心三個原子儘可能在一條直線上。氫原子盡量與Y原子的孤對電子方向一致,這樣引力較大;三個原子儘可能在一條直線上,可使X與Y的距離最遠,斥力最小,形成的氫鍵強。
四、氫鍵對物質性質的影響。
(一)對沸點和熔點的影響
在同類化合物中,能形成分子間氫鍵的物質,其熔點、沸點要比不能形成分子間氫鍵的物質的熔點、沸點高些。因為要使固體熔化或液體汽化,不僅要破壞分子間的范德華力,還必須提供額外的能量破壞氫鍵。H2O,HF,NH3的熔點和沸點比同族同類化合物為高(見表4-3),因為它們都可形成分子間氫鍵。
表4-3 H2O,HF,NH3及其同族同類化合物的熔、沸點
| 化合物 | mp/℃ | bp/℃ | 化合物 | mp/℃ | bp/℃ | 化合物 | mp/℃ | bp/℃ |
| H2O | 0 | 100 | HF | -80.3 | 19.5 | NH3 | -77.7 | -33.4 |
| H2S | -85.6 | -60.7 | HCL | -112 | -84 | PH3 | -133.5 | -87.4 |
| H2Se | -64 | -42 | HBr | -88 | -67.0 | AsH3 | -116 | -62 |
| H2Te | -48 | -1。8 | HI | -50。9 | -35.4 | SbH3 | -88 | -17 |
(二)對溶解度的影響
在極性溶劑中,如果溶質分子和溶劑分子之間可以形成氫鍵,則溶質的溶解度增大。例如,苯胺和苯酚在水中的溶解度比在硝基苯中的溶解度要大。
| 關於「醫用化學/氫鍵」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |